题目内容
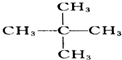
10.已知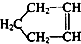 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: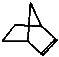
(1)降冰片烯属于b.
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为C7H10;分子中含有官能团双键(填名称).
(3)降冰片烯不具有的性质ad.
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温、常压下为气体
(4)降冰片烯的一氯代物有4种,二氯代物有14种.
分析 (1)降冰片烯为环状烃,且含有碳碳双键;
(2)由结构简式可确定分子中的原子个数;
(3)含有C=C键,结合烯烃的性质来分析解答;
(4)分子中含有几种H就有几种一氯代物,据此判断二氯代物即可.
解答 解:(1)降冰片烯为环状烃,且含有碳碳双键,则属于环烃,也属于烯烃,不含苯环,则不属于芳香烃,故答案为:b;
(2)由结构简式可知1个分子中含7个C原子和10个H原子,则分子式为C7H10,含有1个双键,故答案为:C7H10;双键;
(3)含有C=C键,具有烯烃的性质,则不溶于水,常温常压下不为气体,能发生加成反应和氧化反应,故答案为:ad;
(4)降冰片中含有4种H,故其一氯代物有4种,在双键上取代1个H后,如图: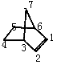 分子中除1外,还剩余6种H,故二氯代物有6种;
分子中除1外,还剩余6种H,故二氯代物有6种;
如图: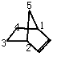 ,剩余4个碳,有4种,故此情况总共4种;
,剩余4个碳,有4种,故此情况总共4种;
如图: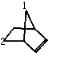 ,均在1号碳上1种,在1、2号碳上1种,故总共2种;
,均在1号碳上1种,在1、2号碳上1种,故总共2种;
如图: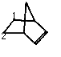 ,均在1号碳上1种,在1、2号碳上一种,故总共2种,综合以上分析,故总共有14种,
,均在1号碳上1种,在1、2号碳上一种,故总共2种,综合以上分析,故总共有14种,
故答案为:4;14.
点评 本题考查有机物的合成及有机物的性质,明确有机物的结构与性质的关系即可解答,注意把握烯烃、醇的性质来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列关于两种有机化合物A和B的说法中错误的是( )
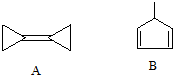

| A. | A的化学式为C6H8 | B. | A的二氯取代产物有4种 | ||
| C. | A与B与溴水反应产物都只有一种 | D. | A分子所有碳原子均在同一平面上 |
1.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂志中不含Fe、S元素.且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸钠主要材料,某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量
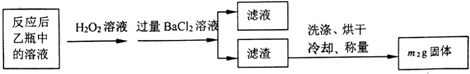
(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为×100%(列出表达式即可).
【实验二】测定铁元素的含量
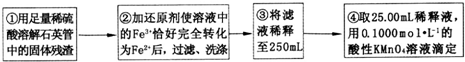
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.500mol/L.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量

(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为×100%(列出表达式即可).
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
5.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | X与Y形成的化合物中必有离子键 | D. | 原子半径Z>Y |
20.物质的量浓度相同的三种正盐NaX、NaY、NaZ的水溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
 与
与
 与
与