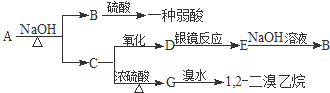
题目内容
16.一定量的锌粉和6mol•L-1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuCl2③铜粉 ④铁粉 ⑤浓盐酸 ⑥硝酸时,能够加快反应速率,又不影响产生H2总量的是( )| A. | ②④⑤ | B. | ①②③⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
分析 盐酸过量锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,注意据此解答.
解答 解:①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuCl2,锌和CuCl2反应生成铜,铜、锌在盐酸溶液中形成原电池反应,加快反应速率,但消耗少量锌,生成氢气量减小,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入硝酸溶液,锌和硝酸反应生成NO不生成氢气,所以生成氢气量减小,故⑥错误;
故选C.
点评 本题考查化学反应速率的影响因素,难度中等,注意加入CuCl2、Fe粉对氢气总量的影响,是本题的易错点.

练习册系列答案
相关题目
4.下列装置所示的实验能达到实验目的是( )
| A. |  分离碘酒中 的碘和酒精 | B. | 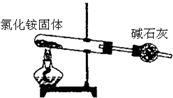 实验室制取氨气 | ||
| C. | 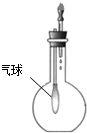 验证NH3的 溶解性 | D. | 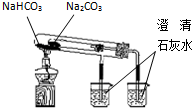 比较Na2CO3、NaHCO3的热稳定性 |
1.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂志中不含Fe、S元素.且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸钠主要材料,某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量
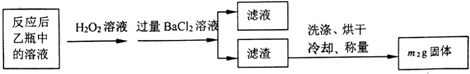
(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量
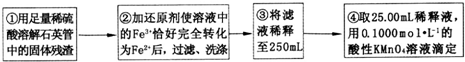
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.500mol/L.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量

(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
8.已知反应:A(g)+B(g)═C(g)+D(g)的能量变化如图所示,下列说法正确的是( )
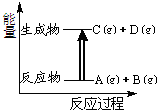

| A. | 若此反应过程中有电子转移,可设计成原电池 | |
| B. | 该反应为吸热反应 | |
| C. | A、B的键能总和小于C、D的键能总和 | |
| D. | 该反应只有在加热条件下才能进行 |
5.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | X与Y形成的化合物中必有离子键 | D. | 原子半径Z>Y |
6.原子的吸收光谱是线状的而不是连续的,主要原因是( )
| A. | 不同轨道上运动的电子具有不同的能量 | |
| B. | 外界条件的影响 | |
| C. | 仪器设备的工作原理 | |
| D. | 原子轨道的能量是量子化的 |