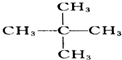
题目内容
17.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白: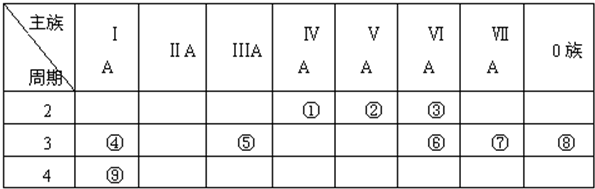
(1)在这些元素中,化学性质不活泼的是Ar(化学符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(化学式),碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)①与⑦的化合物的电子式
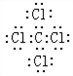 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.(5)写出⑥的原子结构示意图
 .
.
分析 根据元素在周期表中的位置知,①~⑨分别是C、N、O、Na、Al、S、Cl、Ar、K元素,
(1)在这些元素中,化学性质不活泼的是稀有气体元素;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)④与⑥得失电子形成离子化合物;
(4)①与⑦的化合物为CCl4,不同元素之间易形成极性键;
(5)⑥为S原子,S原子核外有3个电子层、最外层电子数是6.
解答 根据元素在周期表中的位置知,①~⑨分别是C、N、O、Na、Al、S、Cl、Ar、K元素,
(1)在这些元素中,化学性质不活泼的是稀有气体元素,这几种元素中惰性气体为Ar,故答案为:Ar;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,剩余元素中非金属性最强的是Cl,则酸性最强的化合物的分子式是HClO4;元素的金属性越强,其最高价氧化物的水化物碱性越强,这几种元素金属性最强的是K,则碱性最强的是KOH,电子式为 ;
;
故答案为:HClO4; ;
;
(3)④与⑥得失电子形成离子化合物Na2S,其形成构过程为 ,
,
故答案为: ;离子;
;离子;
(4)①与⑦的化合物为CCl4,其电子式为 ,不同元素之间易形成极性键,所以C-Cl原子之间存在极性键,故答案为:
,不同元素之间易形成极性键,所以C-Cl原子之间存在极性键,故答案为: ;极性;
;极性;
(5)⑥为S原子,S原子核外有3个电子层、最外层电子数是6,原子结构示意图为 ,
,
故答案为: .
.
点评 本题考查原子结构和元素周期表综合应用,侧重考查基础知识,涉及原子结构、物质结构、元素周期表结构的考查,易错点是四氯化碳电子式的书写,易漏掉孤电子对.

练习册系列答案
相关题目
8.已知反应:A(g)+B(g)═C(g)+D(g)的能量变化如图所示,下列说法正确的是( )
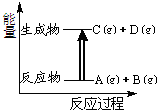

| A. | 若此反应过程中有电子转移,可设计成原电池 | |
| B. | 该反应为吸热反应 | |
| C. | A、B的键能总和小于C、D的键能总和 | |
| D. | 该反应只有在加热条件下才能进行 |
5.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | X与Y形成的化合物中必有离子键 | D. | 原子半径Z>Y |
9.近段时间,朝鲜的“核危机”引起了全球的瞩目,其焦点问题就是朝鲜核电站采用轻水堆还是重水堆,重水堆核电站在发电的同时还可以生产出可供研制核武器的钚(${\;}_{94}^{239}$Pu),下列有关${\;}_{94}^{239}$PuPu的说法不正确的是( )
| A. | ${\;}_{94}^{239}$Pu含94个质子 | |
| B. | ${\;}_{94}^{239}$Pu中的中子数和质子数之差为51 | |
| C. | ${\;}_{94}^{239}$Pu中含有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu具有放射性 |
6.原子的吸收光谱是线状的而不是连续的,主要原因是( )
| A. | 不同轨道上运动的电子具有不同的能量 | |
| B. | 外界条件的影响 | |
| C. | 仪器设备的工作原理 | |
| D. | 原子轨道的能量是量子化的 |
7.下列关于铷(Rb)的叙述正确的是( )
| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
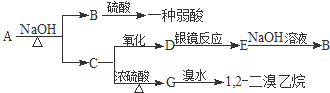


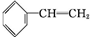 +Br2
+Br2
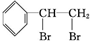 ,反应类型是加成反应;
,反应类型是加成反应; ;
;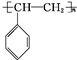 .
.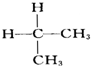 与
与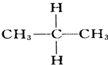
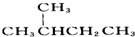 与
与