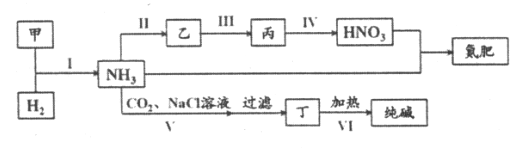
题目内容
【题目】NaNO2一种食品添加剂,它致癌。酸性KMnO4溶液与NaNO2的反应方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.该反应中NO2-被还原
B.反应过程中溶液的pH减小
C.生成1molNaNO3需消耗0.4 mol KMnO4
D.![]() 中的粒子是OH-
中的粒子是OH-
【答案】C
【解析】
该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-应该作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,应该生成硝酸根离子,根据转移电子相等、原子守恒配平方程式为2MnO4-+5NO2-+6H+=2Mn2++5 NO3-+3H2O;
A.该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,故A错误;
B.根据元素守恒、电荷守恒知,□是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;
C.根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量=![]() =0.4mol,故C正确;
=0.4mol,故C正确;
D.由B分析可知,□是H+,故D错误;
故答案为C。

练习册系列答案
相关题目