题目内容
11.元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.(1)B元素在周期表中的位置第四周期ⅡB族; D的最高价氧化物的水化物的化学式为HBrO4.
(2)E的气态氢化物在同族元素中沸点最高的原因是:HF分子间存在氢键,破坏它需要较高的能量.
(3)A、C两元素第一电离能前者大于 后者(填“大于”或“小于”).无论是A和C的单质还是A和C的氢化物的固体,均能与水剧烈反应生成气体,当上述四种固体分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式KH+H2O=KOH+H2↑.
分析 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中E的气态氢化物的沸点最高,则E为F,据此解答.
解答 解:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中E的气态氢化物的沸点最高,则E为F.
(1)B为Zn元素,核外电子排布式为:1s22s22p63s23p63d104s2,处于周期表中第四周期ⅡB族,D为Br元素,它的最高价氧化物的水化物的化学式为HBrO4,
故答案为:第四周期ⅡB族;HBrO4;
(2)HF分子间存在氢键,破坏它需要较高的能量,所以沸点较高,故答案为:HF分子间存在氢键,破坏它需要较高的能量;
(3)Ca元素原子4s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Ca>K;
无论是Ca和K的单质还是它们的氢化物的固体,均能与水剧烈反应生成气体,发生反应为:Ca+2H2O=Ca(OH)2+H2↑、2K+2H2O=KOH+H2↑、CaH2+2H2O=Ca(OH)2+2H2↑、KH+H2O=KOH+H2↑,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式为:KH+H2O=KOH+H2↑,
故答案为:大于;KH+H2O=KOH+H2↑.
点评 本题考查位置结构性质关系应用,涉及核外电子排布、氢键、电离能、化学方程式等知识点,关键掌握核外电子排布规律,注意理解同周期元素第一电离能异常情况.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 等物质的量的N2和CO所含分子数不一定为NA | |
| B. | S.T.P下22.4L CH4所含电子数目为10NA | |
| C. | 1molF-含质子数与电子数之和为10NA | |
| D. | 1molOH-中所含中子数为8NA |
| A. | 物质的溶解性为难溶,即该物质的溶解度为0 | |
| B. | 不溶于水的物质,其Ksp=0 | |
| C. | 绝对不溶于水的物质是不存在的 | |
| D. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 |
| A. | 6 种 | B. | 8 种 | C. | 10 种 | D. | 14 种 |
 .
.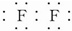 .
.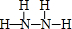 .D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.
.D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.