题目内容
3.已知A、B、C、D为短周期元素形成的四种粒子,它们的核外电子总数都为18,请回答下列问题:(1)A为双核单质分子,可与水发生置换反应,A的电子式为
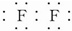 .
.(2)B为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,该反应的离子方程式为Cl2+HS-=S↓+2Cl-+H+.
(3)C为含两种元素的分子,且原子个数比为1:1,实验室中可以用C制备氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(4)D为两种元素组成的六原子分子,常用作火箭的燃料,则D的结构式为
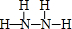 .D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.
.D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.
分析 A、B、C、D为短周期元素形成的四种粒子,它们的核外电子总数都为18.
(1)A为双核单质分子,可与水发生置换反应,则A为F2;
(2)B为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,则B为HS-,与氯气反应生成S与HCl;
(3)C为含两种元素的分子,且原子个数比为1:1,实验室中可以用C制备氧气,则C为H2O2,在二氧化锰作催化剂条件下分解生成水与氧气;
(4)D为两种元素组成的六原子分子,常用作火箭的燃料,则D为N2H4,D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,反应生成氮气与水.
解答 解:A、B、C、D为短周期元素形成的四种粒子,它们的核外电子总数都为18.
(1)A为双核单质分子,可与水发生置换反应,则A为F2,电子式为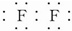 ,故答案为:
,故答案为: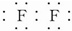 ;
;
(2)B为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,则B为HS-,与氯气反应生成S与HCl,该反应的离子方程式为Cl2+HS-=S↓+2Cl-+H+,故答案为:Cl2+HS-=S↓+2Cl-+H+;
(3)C为含两种元素的分子,且原子个数比为1:1,实验室中可以用C制备氧气,则C为H2O2,在二氧化锰作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(4)D为两种元素组成的六原子分子,常用作火箭的燃料,则D为N2H4,结构式为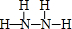 ,D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,反应生成氮气与水,反应方程式为:N2H4+2H2O2=N2+4H2O,
,D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,反应生成氮气与水,反应方程式为:N2H4+2H2O2=N2+4H2O,
故答案为: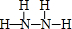 ;N2H4+2H2O2=N2+4H2O.
;N2H4+2H2O2=N2+4H2O.
点评 本题考查物质推断,熟练掌握元素化合物性质,熟记中学常见10电子、18电子微粒.

 名校课堂系列答案
名校课堂系列答案| A. | 氢气通过灼热的氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | |
| B. | 二氧化碳通过Na2O2粉末 2Na2O2+2CO2═2Na2CO3+O2 | |
| C. | 铝与Fe2O3发生铝热反应 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 将锌粒投入Cu(NO3)2溶液 Zn+Cu(NO3)2═Zn(NO3)2+Cu |
| A. | 12C和14C | B. | O2与O3 | ||
| C. | CH3COOH与CH3-O-CHO | D. | CH3CHCH2CH3与CH3CH2CH2CHCH3 |
| A. | 118号元素应该位于周期表的0族元素氡之下 | |
| B. | 制造出的118号元素的一个原子中子数为179,则该原子的摩尔质量297 | |
| C. | 目前还没有发现117号元素,推测117号元素应该属于金属元素 | |
| D. | 118号原子可衰变成116号元素,该过程不属于化学变化 |
| A. | 1 mol Cu2S参加反应时有10 mol电子转移 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 反应中Cu2S作还原剂 | |
| D. | 产物n[Cu(NO3)2]:n[CuSO4]=l:1 |
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
 已知A、B、C、D都是短周期元素,原子序数依次增大,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种4原子的有机分子M,其原子质量比依次为1:6:8.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,原子序数依次增大,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种4原子的有机分子M,其原子质量比依次为1:6:8.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).