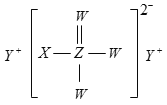题目内容
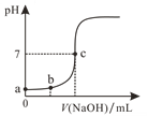
【题目】常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是
A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中![]() 保持不变
保持不变
【答案】D
【解析】
常温下,甲酸和乙酸的电离常数分别为1.8×104和1.8×105,酸强弱为甲酸>乙酸,将pH和体积均相同的两种酸溶液分别稀释,变化大的酸性较强,因此Ⅱ代表甲酸。
A. 根据分析曲线Ⅱ代表甲酸,故A错误;
B. 不断加水,电离程度不断增大,因此酸的电离程度:d点>c点,故B错误;
C. b点pH小,酸性强,抑制水的程度大,因此溶液中水的电离程度:c点>b点,故C错误;
D. 从c点到d点,溶液中![]() ,因此保持不变,故D正确。
,因此保持不变,故D正确。
综上所述,答案为D。

【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。
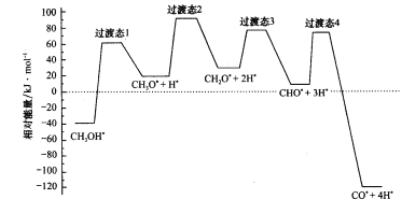
(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。
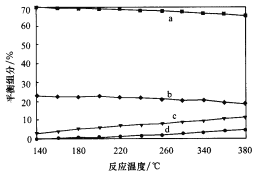
(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
编号 | CO(mol) | H2(mol) | CH3OH(mol) |
Ⅰ | 4 | a | 0 |
Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。