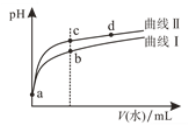
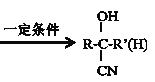
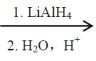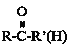题目内容
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___;基态As原子的核外电子排布式为___。
(2)NH3的沸点比PH3的___(填“高”或低”),原因是___。
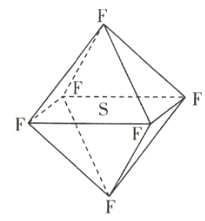
(3)Na3AsO4中含有的化学键类型包括___,AsO43-的空间构型为___。
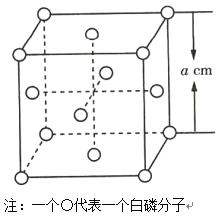
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___,该晶胞的密度为___g·cm-3(用含NA、a的式子表示)。
【答案】N>P>As 1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 高 NH3和PH3均为分子晶体,但NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力 离子键、共价键 正四面体形 16 ![]()
【解析】
(1)同主族元素从上到下第一电离能减小,所以N、P、As的第一电离能由大到小的顺序为N>P>As;根据能量最低原则,基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:N>P>As;1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力,所以NH3的沸点比PH3的高,
故答案为:高;NH3和PH3均为分子晶体,但NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力;
(3)Na3AsO4是离子化合物,含有离子键,![]() 中As与O之间是共价键,所以Na3AsO4中含有的化学键类型包括离子键、共价键;
中As与O之间是共价键,所以Na3AsO4中含有的化学键类型包括离子键、共价键;![]() 的价电子对数
的价电子对数![]() ,无孤电子对,所以
,无孤电子对,所以![]() 的空间构型为正四面体形,
的空间构型为正四面体形,
故答案为:离子键、共价键;正四面体形;
(4)根据晶胞结构可知一个晶胞中P原子数![]() ;该晶胞的摩尔质量是16×31g/mol=496g/mol,该晶胞的体积是a3cm3,该晶胞的密度为
;该晶胞的摩尔质量是16×31g/mol=496g/mol,该晶胞的体积是a3cm3,该晶胞的密度为![]() ,
,
故答案为:16;![]() 。
。

【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
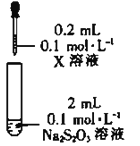
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1