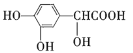
题目内容
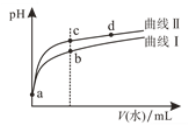
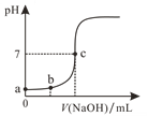
【题目】298 K时,在20.0mL 0.10mol/LH2SO4溶液中滴入0.10 mol/L的NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列叙述正确的是
A.滴定过程最好用甲基橙作指示剂
B.a点溶液的pH=1.0
C.b点溶液中c(H+)=0.05mol/L
D.c点对应的NaOH溶液体积为20.0mL
【答案】C
【解析】
A. 甲基橙变色点为3.1~4.4,酚酞变色点为8.2~10.0,中性靠近酚酞变色点,因此强碱滴定强酸,其滴定过程最好用酚酞作指示剂,故A错误;
B. 0.10 molL1 H2SO4溶液,c(H+)=0.2 molL1,a点溶液的pH<1.0,故B错误;
C. c点pH=7,说明恰好完全反应,则n(H+)=n(OH-),0.10 molL1×0.02L×2 = V(NaOH) ×0.10 molL1,V(NaOH) = 0.04L =40mL,根据图像b点加NaOH溶液体积是c点一半即为20mL,则溶液中![]() ,故C正确;
,故C正确;
D. 根据C选项分析得到c点对应体积为40mL,故D错误。
综上所述,答案为C。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。
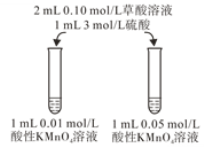
(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。