题目内容
15.含硫化合物在生产、生活中有广泛应用.其吸收和处理也十分重要.完成下列填空:(1)SO2具有还原性,可以和许多氧化剂反应.SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2•12H2O].写出该反应的化学方程式.3SO2+K2Cr2O7+11H2O+H2SO4=2KCr(SO4)2.12H2O,反应中被还原的元素是Cr
(2)过量的SO2通入Na2S溶液,写出离子方程式2H2O+2S2-+5SO2=4HSO3-+3S↓,氧化剂与还原剂的物质的量之比1:2
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量,例如:
c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3)、c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-)
(4)等物质的量浓度的(NH4)2SO3,NH4HSO3,NH4HCO3溶液,NH4+浓度由大到小排列:(NH4)2SO3、NH4HSO3、NH4HCO3
(5)将白色Cu2SO3固体加入到足量盐酸中,有红色固体生成.产物还有CuCl2、SO2和水.过滤后,将溶液蒸干灼烧后得到的固体是CuO.
分析 (1)该反应中S元素化合价由+4价变为+6价、Cr元素化合价由+6价变为+3价,转移电子数为6,根据转移电子相等配平方程式得;得电子化合价降低的元素被还原;
(2)过量的SO2通入Na2S溶液,二者发生氧化还原反应生成S,同时生成亚硫酸氢钠,该反应中S元素化合价由+4价、-2价变为0价,所以部分二氧化硫是氧化剂、硫化钠是还原剂;
(3)n(NaOH)=0.3mol/L×1L=0.3mol,n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒;
(4)弱酸根离子促进铵根离子水解,物质的量浓度相等的这三种物质,铵根离子水解但程度较小,所以铵根离子系数越大,溶液中铵根离子浓度越大;亚硫酸氢根离子水解程度小于碳酸氢根离子,弱酸根离子水解程度越大,铵根离子浓度越小;
(5)Cu2SO3固体加入到足量盐酸中,发生氧化还原反应Cu2+和Cu,发生复分解反应生成SO2和H2O,所以得到的溶液是CuCl2溶液,加热过程中氯化铜水解生成Cu(OH)2和HCl,升高温度促进CuCl2水解,蒸干时得到Cu(OH)2Z,灼烧固体时Cu(OH)2发生分解反应.
解答 解:(1)该反应中S元素化合价由+4价变为+6价、Cr元素化合价由+6价变为+3价,转移电子数为6,根据转移电子相等配平方程式3SO2+K2Cr2O7+11H2O+H2SO4=2KCr(SO4)2.12H2O;得电子化合价降低的元素被还原,则Cr元素被还原,
故答案为:3SO2+K2Cr2O7+11H2O+H2SO4=2KCr(SO4)2.12H2O;Cr;
(2)过量的SO2通入Na2S溶液,二者发生氧化还原反应生成S,同时生成亚硫酸氢钠,离子方程式为2H2O+2S2-+5SO2=4HSO3-+3S↓,该反应中S元素化合价由+4价、-2价变为0价,所以$\frac{1}{5}$的二氧化硫是氧化剂、硫化钠是还原剂,则氧化剂和还原剂的物质的量之比是1:2,
故答案为:2H2O+2S2-+5SO2=4HSO3-+3S↓;1:2;
(3)n(NaOH)=0.3mol/L×1L=0.3mol,n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),根据物料守恒得2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),根据质子守恒得c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-),
故答案为:2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3);c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-);
(4)弱酸根离子促进铵根离子水解,物质的量浓度相等的这三种物质,铵根离子水解但程度较小,所以铵根离子系数越大,溶液中铵根离子浓度越大;亚硫酸氢根离子水解程度小于碳酸氢根离子,弱酸根离子水解程度越大,铵根离子浓度越小,所以这三种等物质的量的铵盐铵根离子浓度大小顺序是(NH4)2SO3、NH4HSO3、NH4HCO3,
故答案为:(NH4)2SO3、NH4HSO3、NH4HCO3;
(5)Cu2SO3固体加入到足量盐酸中,发生氧化还原反应Cu2+和Cu,发生复分解反应生成SO2和H2O,所以得到的溶液是CuCl2溶液,加热过程中氯化铜水解生成Cu(OH)2和HCl,升高温度促进CuCl2水解,蒸干时得到Cu(OH)2Z,灼烧固体时Cu(OH)2发生分解反应生成CuO,所以最终得到的固体是CuO,
故答案为:CuCl2;SO2;CuO.
点评 本题考查含硫物质的综合应用,涉及氧化还原反应、复分解反应、盐类水解、离子浓度大小比较等知识点,侧重考查基本理论,这些知识点都是高频考点,明确物质的性质是解本题关键,难点是(2)(3)(5)的有关判断,题目难度中等.

 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )| A. | Ⅰ和Ⅲ附近 | B. | Ⅰ和Ⅳ附近 | C. | Ⅱ和Ⅲ附近 | D. | Ⅱ和Ⅳ附近 |
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a |
| A. | 在0.1mol•L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
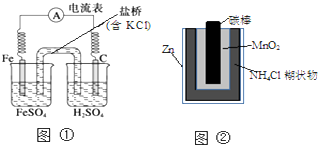
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
| A. | 乙醇可由淀粉、纤维素等在一定条件下制得 | |
| B. | 乙醇、乙酸生成乙酸乙酯的反应属于取代反应 | |
| C. | 乙醇可与NaOH稀溶液反应 | |
| D. | 乙醇与二甲醚(CH3 OCH3)是同分异构体 |
 、NO
、NO
 、NO
、NO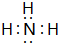 .
.