题目内容
3.下列说法不正确的是( )| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a |
分析 A.当乙酸远远过量时,则满足:c(CH3COO-)>c(H+)>c(Na+);
B.醋酸为弱酸,稀释后醋酸溶液中氢离子浓度变化较小,则与锌反应时的反应速率较大;
C.根据混合液中的物料守恒判断;
D.由水电离出的c(H+)=l×10-amol•L-1,该溶液可能是酸性溶液,也可能是碱性溶液,据此计算判断,注意为酸性溶液时,溶液中氢氧根离子浓度等于水电离的氢离子浓度,利用水的离子积计算溶液中氢离子,再根据pH=-logc(H+)计算pH.
解答 解:A.25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,且醋酸远远过量,则溶液中离子浓度大小为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故A正确;
B.取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,醋酸为弱电解质,则稀释后醋酸中氢离子的物质的量会增大,稀释后的溶液中醋酸的氢离子浓度会大于盐酸,所以分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大,故B正确;
C.含等物质的量的NaHC2O4和Na2C2O4的溶液中,根据物料守恒可得:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故C正确;
D.由水电离出的c(H+)=l×10-amol•L-1,该溶液若为酸性溶液,则溶液中c(OH-)=l×10-amol•L-1,故溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-a}}$mol/L=l×10-14+amol/L,故pH=-logl×10-14+a=14-a,该溶液若为碱性溶液,则溶液pH=-logl×10-a=a,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及水的电离及其影响、弱电解质的电离、化学反应速率的影响、离子浓度大小比较等知识,试题知识点较多,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | Li为电池的负极 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经外电路流向正极 | |
| D. | 充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.

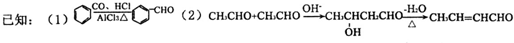
 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. 或
或 .
.
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.