题目内容
20.下列叙述中正确的是( )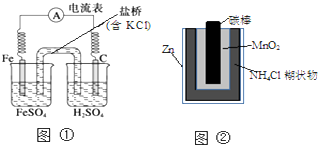
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
分析 A、正极的电极反应式为:2H++2e-=H2↑,氢离子浓度减小;
B、正极材料为MnO2,发生还原反应,电极反应式为2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O;
C、电子由负极流向正极,阴离子向负极移动;
D、氯化铵溶液显酸性,锌在酸性环境中容易失电子,表现出还原性.
解答 解:A、正极的电极反应式为:2H++2e-=H2↑,氢离子浓度减小,附近溶液pH增大,故A错误;
B、正极材料为MnO2,发生还原反应,电极反应式为2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O,故B错误;
C、电子由负极流向正极,所以电子由Fe流向石墨,阴离子向负极移动,即FeSO4溶液,故C正确;
D、该原电池中锌作负极,负极上失电子发生氧化反应,所以Zn-MnO2干电池自放电腐蚀主要是由Zn的还原作用引起的,故D错误;
故选C.
点评 本题考查原电池的组成和工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意电极的组成和电极反应式以及总反应式的书写.

练习册系列答案
相关题目
13.浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半.若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2$?_{充电}^{放电}$4LiCl+S+SO2.下列说法不正确的是( )
| A. | Li为电池的负极 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经外电路流向正极 | |
| D. | 充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
8.在给定条件下,下列画线物质在化学反应中能被完全消耗的是( )
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
8.下列鉴别方法一定不可行的是( )
| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
9.已知外电路中,电子由铜流向a极.有关如图所示装置的分析中,合理的一项是( )

| A. | 一段时间后Zn电极逐渐溶解 | |
| B. | 该装置中Cu极为正极,发生还原反应 | |
| C. | b极反应的电极反应式为:H2-2e-=2H+ | |
| D. | 电流方向:a电极→ →Cu电极 →Cu电极 |
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.