题目内容
3.(Ⅰ) 某钠盐溶液中通入足量氨气,无明显现象.再在所得溶液中通入过量CO2,产生大量白色沉淀.(1)写出氨气的电子式
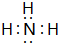 .
.(2)该钠盐溶液中一定不可能含有下列哪种微粒B(填编号).
A.Cl-B.Fe2+C.SiO32-D.AlO2-
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-.
(Ⅱ) 电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放.某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:

已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L.
(4)沉淀D的化学式是CuCN.
(5)写出沉淀D在氧气中灼烧发生的化学方程式2CuCN+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+N2+2CO2.
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理2CN-+5ClO-+2H+=5Cl-+N2↑+2CO2↑+H2O.
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液可以,因为Na2SO3具有还原性,有可能将Cu2+还原为Cu+离子,
并设计实验证明所用Na2SO3溶液是否变质取少许Na2SO3溶液于试管中,加入足量稀盐酸,再加入氯化钡溶液,若有沉淀生成,说明Na2SO3溶液变质,否则,说明Na2SO3溶液未变质.
分析 (Ⅰ) (1)氨气分子中N原子与H原子之间形成1对共用电子对;
(2)某钠盐溶液中通入足量氨气,无明显现象,再在所得溶液中通入过量CO2,产生大量白色沉淀,不可能可以Fe2+,因通入氨气会产生白色沉淀,迅速变化灰绿色,最终变为红褐色;可能为硅酸钠、偏铝酸钠,可能为NaCl(侯德邦制碱法);
(3)过量二氧化碳与偏铝酸钠(或硅酸钠)反应生成氢氧化铝沉淀与碳酸氢钠(或硅酸沉淀碳酸氢钠)等;
(Ⅱ)9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,黑色固体应为CuO,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L,气体的相对分子质量为1.25×22.4=28,电镀溶液中含有高浓度的CN-离子,应为氮气,则白色沉淀为CaCO3,其物质的量为$\frac{10g}{100g/mol}$=0.1mol,碳元素质量为0.1mol×12g/mol=1.2g,氮气的质量为1.25g×1.12L=1.4g,物质的量为$\frac{1.4g}{28g/mol}$=0.05mol,CuO的物质的量为$\frac{8g}{80g/mol}$=0.1mol,C、N、Cu元素总质量为1.2g+1.4g+0.1mol×64g/mol=9g,等于沉淀D的质量,故D由Cu、C、N三种元素组成,且三原子物质的量之比为0.1mol:0.1mol:0.05mol×2=1:1:1,故D的化学式为CuCN,A离子为CN-离子、X为Cu+离子.
(6)CN-离子与NaClO在酸性条件转化为对环境无害的物质,应是生成氮气、二氧化碳,还有氯化钠与水生成;
(7)Na2SO3具有还原性,有可能将Cu2+还原为Cu+离子;
Na2SO3溶液变质为生成Na2SO4,可以利用氯化钡溶液检验溶液中是否含有硫酸根,注意加入盐酸排除亚硫酸根离子的影响.
解答 解:(Ⅰ) (1)氨气分子中N原子与H原子之间形成1对共用电子对,电子式为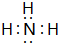 ,
,
故答案为: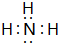 ;
;
(2)某钠盐溶液中通入足量氨气,无明显现象,再在所得溶液中通入过量CO2,产生大量白色沉淀,不可能可以Fe2+,因通入氨气会产生白色沉淀,迅速变化灰绿色,最终变为红褐色;可能为硅酸钠、偏铝酸钠,可能为NaCl(侯德邦制碱法),可能含有Cl-、SiO32-、AlO2-,
故选:B;
(3)过量二氧化碳与偏铝酸钠(或硅酸钠)反应生成氢氧化铝沉淀与碳酸氢钠(或硅酸沉淀碳酸氢钠)等,反应离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;
(Ⅱ)9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,黑色固体应为CuO,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L,气体的相对分子质量为1.25×22.4=28,电镀溶液中含有高浓度的CN-离子,应为氮气,则白色沉淀为CaCO3,其物质的量为$\frac{10g}{100g/mol}$=0.1mol,碳元素质量为0.1mol×12g/mol=1.2g,氮气的质量为1.25g×1.12L=1.4g,物质的量为$\frac{1.4g}{28g/mol}$=0.05mol,CuO的物质的量为$\frac{8g}{80g/mol}$=0.1mol,C、N、Cu元素总质量为1.2g+1.4g+0.1mol×64g/mol=9g,等于沉淀D的质量,故D由Cu、C、N三种元素组成,且三原子物质的量之比为0.1mol:0.1mol:0.05mol×2=1:1:1,故D的化学式为CuCN,A离子为CN-离子、X为Cu+离子.
(4)沉淀D的化学式是:CuCN,故答案为:CuCN;
(5)沉淀D在氧气中灼烧发生的化学方程式:2CuCN+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+N2+2CO2,
故答案为:2CuCN+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+N2+2CO2;
(6)CN-离子与NaClO在酸性条件转化为对环境无害的物质,应是生成氮气、二氧化碳,还有氯化钠与水生成,反应离子方程式为:2CN-+5ClO-+2H+=5Cl-+N2↑+2CO2↑+H2O,
故答案为:2CN-+5ClO-+2H+=5Cl-+N2↑+2CO2↑+H2O;
(7)Na2SO3具有还原性,有可能将Cu2+还原为Cu+离子,可以用Na2SO3溶液来代替B溶液;
Na2SO3溶液变质为生成Na2SO4,检验Na2SO3溶液是否变质的方法为:取少许Na2SO3溶液于试管中,加入足量稀盐酸,再加入氯化钡溶液,若有沉淀生成,说明Na2SO3溶液变质,否则,说明Na2SO3溶液未变质,
故答案为:可以,因为Na2SO3具有还原性,有可能将Cu2+还原为Cu+离子;取少许Na2SO3溶液于试管中,加入足量稀盐酸,再加入氯化钡溶液,若有沉淀生成,说明Na2SO3溶液变质,否则,说明Na2SO3溶液未变质.
点评 本题考查无机物推断、电子式、离子方程式书写等,属于拼合型题目,(II)中推断难度很大,属于猜测验证型,需要学生具备扎实的基础,难度较大.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
CH3OH (g)+H2O (g)?CO2(g)+3H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
H2(g)+O2(g)?H2 O(g)△H2=-120.9kJ/mol K2
则甲醇与水蒸气催化重整反应的焓变△H3=-72.0kJ/mol.
(2)10~30 min内,氢气的平均反应速率v(H2)=0.06mol/(L•min).
(3)该反应的平衡常数表达式为K=$\frac{{K}_{1}}{{K}_{2}}$.
(4)下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$)减小的是(双选)CD.
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.再充入1molH2O.

 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. 或
或 .
. 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.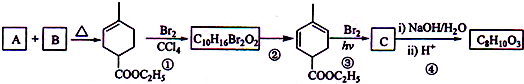
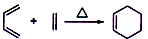
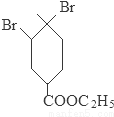 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;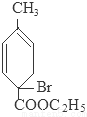 +2H2O
+2H2O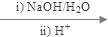
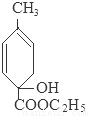 +C2H5OH+HBr:
+C2H5OH+HBr: .
.

 .
.