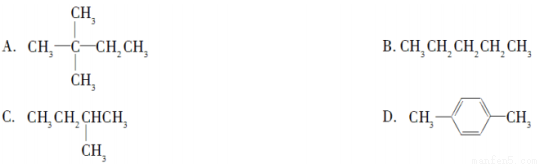题目内容
8. 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )| A. | Ⅰ和Ⅲ附近 | B. | Ⅰ和Ⅳ附近 | C. | Ⅱ和Ⅲ附近 | D. | Ⅱ和Ⅳ附近 |
分析 第一个装置是电解池,铁为阳极,溶液中的H+在Ⅰ处得电子,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅰ处变红.第二个装置是原电池,Zn为负极,溶液中的氧气在Ⅳ处得电子生成OH-,所以Ⅳ处变红.
解答 解:第一个图示是电解池,铁做阳极,铁失电子生成亚铁离子,锌做阴极,在阴极上,2H++2e-=H2↑,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅰ处也变红;
第二个图示是原电池,锌做负极,锌失电子形成锌离子,正极是Ⅳ,在正极上,O2+2H2O+4e-=4OH-;所以Ⅳ处变红;
故选B.
点评 本题考查了原电池和电解池的工作原理的应用,主要是电解反应的离子变化.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组是 ( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
② | Fe(NO3)2溶液 | AgNO3溶液 | 加入足量铁粉,并过滤 |
③ | O2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
A.①④ B.② C.②④ D.②③
3.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
13.浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半.若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2$?_{充电}^{放电}$4LiCl+S+SO2.下列说法不正确的是( )
| A. | Li为电池的负极 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经外电路流向正极 | |
| D. | 充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |

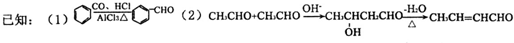
 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. 或
或 .
.