题目内容
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用![]() (熔点2045℃)和冰晶石(
(熔点2045℃)和冰晶石(![]() )混合熔融后电解制得。请回答下列问题:
)混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
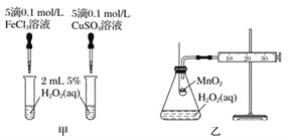
(2)将![]() 液和
液和![]() 溶液混合制取
溶液混合制取![]() 。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成![]() 。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的
。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的![]() 对人类健康会产生危害,为了降低水源中
对人类健康会产生危害,为了降低水源中![]() 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将![]() 还原为N2,此时铝主要以
还原为N2,此时铝主要以![]() 的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的
的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的![]() 在标况下的体积约为_______L。
在标况下的体积约为_______L。
【答案】铝的表面可以形成一层致密的氧化铝薄膜,保护铝不被进一步氧化 ![]() 不能
不能 ![]() 会水解产生氢氟酸,氢氟酸会腐蚀玻璃 ABD
会水解产生氢氟酸,氢氟酸会腐蚀玻璃 ABD 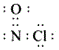
![]() 11.2L
11.2L
【解析】
(1)铝的表面可以形成一层致密的氧化铝薄膜,保护铝不被进一步氧化,因此可以在空气中稳定存在,铝作还原剂冶炼金属,自身变成氧化铝,可以类比氧化铁的铝热反应:![]() ;
;
(2)根据“有弱就水解,越弱越水解”的规律,![]() 会水解产生氢氟酸,氢氟酸本身会腐蚀玻璃,因此不能用玻璃瓶来盛放;
会水解产生氢氟酸,氢氟酸本身会腐蚀玻璃,因此不能用玻璃瓶来盛放;
(3)A.尽管铝是地壳中含量最高的金属元素,但是提炼铝的方法是近两三个世纪才发现的,铝的大规模使用是上个世纪七十年代才开始的,A项错误;
B.铝和强酸强碱均能反应,但是镁只能和盐酸反应,不能和氢氧化钠溶液反应,因此镁不溶于烧碱溶液,B项错误;
C.![]() 是一种两性氢氧化物,既能溶于盐酸得到
是一种两性氢氧化物,既能溶于盐酸得到![]() 又能溶于烧碱得到
又能溶于烧碱得到![]() ,C项正确;
,C项正确;
D.过多摄入![]() 对人体实际上是有害的,因此我们应减少铝制餐具的使用,并且在使用时避免接触强酸或强碱性的食品,D项错误;
对人体实际上是有害的,因此我们应减少铝制餐具的使用,并且在使用时避免接触强酸或强碱性的食品,D项错误;
答案选ABD;
(4)既然各原子均满足8电子稳定结构,氮要形成3个共价键,氧要形成2个共价键,氯只能形成1个共价键,不难发现应写成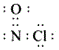 的形式,1个铝失3个电子,1个氮得5个电子,写出反应方程式:
的形式,1个铝失3个电子,1个氮得5个电子,写出反应方程式:![]() ,根据方程式不难看出转移电子数与生成氮气数之比为10:1,故当转移5mol电子时生成0.5mol氮气,这些氮气在标况下的体积为
,根据方程式不难看出转移电子数与生成氮气数之比为10:1,故当转移5mol电子时生成0.5mol氮气,这些氮气在标况下的体积为![]() 。
。