题目内容
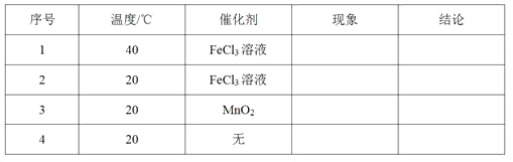
【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
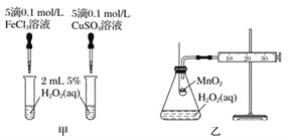
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。

【答案】4.30 10.70 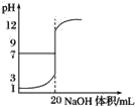 12.50
12.50
【解析】
强酸与强碱混合后,如果酸过量可直接求出混合后c(H+),再求pH;如果碱过量,一般先求出混合后的c(OH-),后由水的离子积常数转换成c(H+),再求pH;如果n(OH-)和n(H+)相等,溶液呈中性。
V(NaOH)=19.98 mL,酸过量,c(H+)=![]() ≈5×10-5mol·L-1,pH=-lg5×10-5=4.3;V(NaOH)=20.20mL:碱过量,c(OH-)=
≈5×10-5mol·L-1,pH=-lg5×10-5=4.3;V(NaOH)=20.20mL:碱过量,c(OH-)=![]() ≈5×10-4mol·L-1,c(H+)=2×10-11mol·L-1,pH=-lg2×10-11=10.70;
≈5×10-4mol·L-1,c(H+)=2×10-11mol·L-1,pH=-lg2×10-11=10.70;
(1)根据表中NaOH溶液体积及溶液的pH,可以绘制出滴定曲线为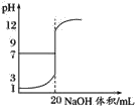 ;
;
(2)滴定管准确度为0.01 mL,由上到下刻度读数越来越大,Ⅰ中液面在刻度线1以下的第四个小刻度处,初读数为1.40 mL,Ⅱ中在刻度线13以下差一个小刻度线到14,读数为13.90 mL,滴定液的用量为13.90 mL-1.40 mL=12.50 mL。