题目内容
15.化学与生产、生活密切相关,下列叙述正确的是( )| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均属于物理变化 | |
| B. | BaSO4难溶于水,属于弱电解质,在医学上用作钡餐 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min 方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 明矾和氯气均用于水的消毒、杀菌 |
分析 A.煤的干馏有新物质生成;
B.电解质强弱与溶解度无关,取决于电离程度;
C.高温能够使蛋白质变性;
D.明矾可作为净水剂,用于吸附水中悬浮杂质使其沉降;氯气溶于水生成次氯酸,用于杀菌消毒.
解答 解:A.煤的干馏属于化学变化,故A错误;
B.硫酸钡熔融状态下能够完全电离属于强电解质,故B错误;
C.病菌属于蛋白质,高温能够使蛋白质变性,故C正确;
D.明矾可作为净水剂,用于吸附水中悬浮杂质使其沉降;氯气溶于水生成次氯酸,用于杀菌消毒,故D错误,
故选C.
点评 本题考查了物理变化和化学变化的判断、电解质强弱的判断、蛋白质、明矾、氯气的性质,题目难度不大,注意电解质强弱取决于电离程度,与溶解度无关.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
18.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 11.2L甲烷含有的氢原子数为2NA | |
| B. | 1mol氧气在化学反应中得到的电子数一定为4NA | |
| C. | 28g丙烯中含有的碳氢键的数目为4NA | |
| D. | 1mol/L的硝酸中含有的硝酸根离子的数目为4NA |
6.分子式为C5H10O2的羧酸共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 种 |
3.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和Si | B. | CO2和CH4 | C. | CsCl和H2SO4 | D. | CCl4和KCl |
10.25°C和101kpa时,甲烷、乙烯和乙炔组成的混合烃30mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了55mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 33.3% | C. | 66.7% | D. | 75% |
20.下列离子方程式书写正确的是( )
| A. | 酸性高锰酸钾与少量双氧水反应:2MnO4-+3H2O2+6H+═2Mn2++3O2↑+6H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向NaClO溶液中通入过量CO2;CO2+ClO-+H2O═HCO3-+HClO |
4.下列有关实验说法错误的是( )
| A. | 在0.1mol/LK2Cr2O4溶液中,滴加3滴浓硫酸,K2Cr2O4溶液颜色会改变 | |
| B. | 在做温度对反应速率的影响实验时,应该将Na2S2O3和稀硫酸分别加热到设定温度再混合 | |
| C. | 恒温恒容已达H2(g)+I2(g)?2HI(g)平衡的容器中,充入少量HI(g),容器中气体颜色不变 | |
| D. | 不断读取数据,直到出现下降,取最大值,即为中和反应反应热的测定中混合溶液的最高温度 |
5.已知298K时,2SO2 (g)+O2(g)?2SO3(g);△H=-197kJ/mol,在相同温度和压强下,向某密闭容器中通人2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一容积相同的密闭容器中通人1mol SO2和0.5mol O2,达到平衡时放出热量Q2,下列关系式正确的是( )
| A. | Q2 =$\frac{{Q}_{1}}{2}$ | B. | Q2 >$\frac{{Q}_{1}}{2}$ | C. | Q1 =Q2=197 kJ | D. | Q2 <$\frac{{Q}_{1}}{2}$<$\frac{197}{2}$kJ |
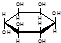 与葡萄糖
与葡萄糖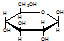 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物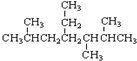 的名称为2,5,6-三甲基-4-乙基庚烷.
的名称为2,5,6-三甲基-4-乙基庚烷.