题目内容
18.NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 11.2L甲烷含有的氢原子数为2NA | |
| B. | 1mol氧气在化学反应中得到的电子数一定为4NA | |
| C. | 28g丙烯中含有的碳氢键的数目为4NA | |
| D. | 1mol/L的硝酸中含有的硝酸根离子的数目为4NA |
分析 A.没有告诉在标况下,不能使用标况下的气体摩尔体积计算;
B.1mol氧气与金属钠反应生成1mol过氧化钠,转移了2mol电子;
C.根据n=$\frac{m}{M}$计算出丙烯的物质的量,1mol丙烯中含有6mol碳氢键;
D.缺少硝酸溶液体积,无法计算溶液中硝酸根离子的数目.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算11.2L甲烷的物质的量,故A错误;
B.钠与氧气反应生成过氧化钠,1mol氧气完全反应生成了1mol过氧化钠,转移了2mol电子,1mol氧气得到的电子数一定为2NA,故B错误;
C.28g丙烯的物质的量为:$\frac{28g}{42g/mol}$=$\frac{2}{3}$mol,丙烯中含有6个碳氢键,则28g丙烯中含有的碳氢键的物质的量为:$\frac{2}{3}$mol×6=4mol,含有的碳氢键的数目为4NA,故C正确;
D.没有告诉硝酸的体积,无法计算溶液中含有硝酸根离子的数目,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,D为易错点,注意题中缺少溶液体积.

练习册系列答案
相关题目
8.下列叙述中正确的是( )
| A. | 某物质中只含一种元素,该物质一定是纯净物 | |
| B. | H2和D2互为同位素 | |
| C. | 40K和40Ca原子中的质子数和中子数都不相等 | |
| D. | 金刚石和石墨的性质相同 |
9.下列有关因果关系的描述正确的是( )
| A. | 因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫 | |
| B. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl?K↑+NaCl) | |
| C. | 因为某吸热反应能自发进行,所以该反应是熵减反应 | |
| D. | 因为醋酸电离吸热,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,前者放出热量少 |
3.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )
| A. | Na+ | B. | NO3- | C. | Mg2+ | D. | OH- |
10.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A. | 体积比为8:11 | B. | 分子个数之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
7.下列对应的表达方式错误的是( )
| A. | Cl-的结构示意图: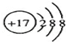 | B. | 氢氧根离子的电子式: | ||
| C. | ${\;}_{6}^{12}$C的质量数为12 | D. | HClO的结构式:H-Cl-O |
15.化学与生产、生活密切相关,下列叙述正确的是( )
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均属于物理变化 | |
| B. | BaSO4难溶于水,属于弱电解质,在医学上用作钡餐 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min 方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 明矾和氯气均用于水的消毒、杀菌 |
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
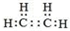 ,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;
,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;