题目内容
5.已知298K时,2SO2 (g)+O2(g)?2SO3(g);△H=-197kJ/mol,在相同温度和压强下,向某密闭容器中通人2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一容积相同的密闭容器中通人1mol SO2和0.5mol O2,达到平衡时放出热量Q2,下列关系式正确的是( )| A. | Q2 =$\frac{{Q}_{1}}{2}$ | B. | Q2 >$\frac{{Q}_{1}}{2}$ | C. | Q1 =Q2=197 kJ | D. | Q2 <$\frac{{Q}_{1}}{2}$<$\frac{197}{2}$kJ |
分析 SO2(g)+O2(g)?2SO3(g)△H=-Q1KJ/mol,表示一定条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为197kJ,可逆反应中反应物不能完全反应;
另一容积相同的密闭容器中通人1mol SO2和0.5mol O2,等效为开始通入2mol SO2和1mol O2到达平衡的基础上压强减小一倍,平衡向逆反应移动,二氧化硫的转化率减小.
解答 解:SO2(g)+O2(g)?2SO3(g)△H=-Q1KJ/mol,表示一定条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为197kJ;
可逆反应中反应物不能完全反应,故向密闭容器中通入2molSO2和1molO2,参加反应的二氧化硫的物质的量小于2mol,故平衡时放出的热量小于197kJ,即Q1<197kJ,
另一容积相同的密闭容器中通人1mol SO2和0.5mol O2,等效为开始通入2mol SO2和1mol O2到达平衡的基础上压强减小一倍,平衡向逆反应移动,二氧化硫的转化率减小,参加反应的二氧化硫的物质的量小于上述平衡的$\frac{1}{2}$,故平衡时放出的热量Q2 <$\frac{{Q}_{1}}{2}$,
故Q2<$\frac{{Q}_{1}}{2}$<$\frac{197}{2}$kJ,
故选D.
点评 本题考查可逆反应特点、热化学方程式、等效平衡等,难度中等,注意对热化学方程式表示的含义理解,注意等效平衡的运用.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
15.化学与生产、生活密切相关,下列叙述正确的是( )
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均属于物理变化 | |
| B. | BaSO4难溶于水,属于弱电解质,在医学上用作钡餐 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min 方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 明矾和氯气均用于水的消毒、杀菌 |
16.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )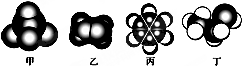

| A. | 甲的二氯代物只有一种 | |
| B. | 乙能与溴水发生取代反应而使溴水褪色 | |
| C. | 1mol丙中含有碳碳双键的数目是3NA | |
| D. | 丁在稀硫酸作用下可与甲酸发生取代反应 |
20.下列各组离子在指定溶液中能够大量共存的是( )
| A. | 无色溶液:K+、Al3+、NO3-、HCO3- | |
| B. | 常温下c(H+)/c(OH-)=1×10-12的溶液:Na+、K+、AlO2-、CO32- | |
| C. | 强酸性溶液:NH4+、Na+、SO32-、NO3- | |
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
15.已知某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg(D+),以下关于pD的叙述正确的是( )
| A. | 该温度下纯重水的pD=7 | |
| B. | 在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12 | |
| C. | 向100mL 0.25mol•L-1的DCl重水溶液中加入50mL 0.2mol•L-1的NaOD的重水溶液,其中pD=2 | |
| D. | 在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2 |
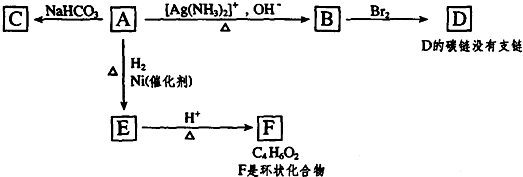
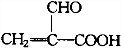 .
.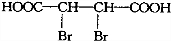 .
.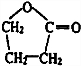 .
.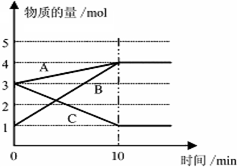 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.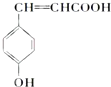 .
.