题目内容
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为________,电负性由大到小的顺序为________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是______________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_____________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
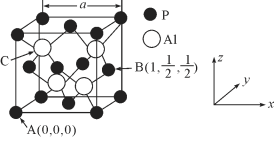
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm,其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
【答案】4s24p3 Cl>P>S Cl>S>P 氧的电负性大且原子半径小,H2O分子间可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键 sp σ键和π键 ![]() 原子晶体 (1/4,1/4,3/4)
原子晶体 (1/4,1/4,3/4) ![]()
【解析】
(1)砷的核电荷数为33,基态砷原子的核外电子排布式为[Ar]4s24p3,价电子排布式为4s24p3,故答案为:4s24p3。
(2)P、S、Cl均为第三周期主族元素,它们的第一电离能呈增大趋势,但P原子的3p轨道为半充满结构相对稳定,三种原子的第一电离能由大到小的顺序为Cl>P>S,非金属性越强,电负性越大,三种元素的电负性由大到小的顺序为Cl>S>P;故答案为:Cl>P>S;Cl>S>P。
(3)氧的电负性大且原子半径小,H2O分子间可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键,故H2O可以形成H9O4+以或H3O+,而H2S几乎不能形成类似的H9S4+或H3S+;故答案为:氧的电负性大且原子半径小,H2O分子间可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键
(4)COS分子的结构式为O=C=S,含有δ键和π键,COS分子中C原子形成2个δ键,孤对电子数为![]() =0,则为sp杂化,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则结构式为N=N=O,电子式为
=0,则为sp杂化,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则结构式为N=N=O,电子式为![]() ,故答案为:sp,σ键和π键,
,故答案为:sp,σ键和π键,![]() 。
。
(5)①AlP晶体熔点为2000℃,且晶胞中形成的是立体网状结构,应为原子晶体;故答案为:原子晶体。
②A、B点的原子坐标分别为(0、0、0)、(1、1/2、1/2)可知晶胞边长为1,由此可推知C点的原子坐标为(1/4、1/4、3/4);故答案为:(1/4、1/4、3/4)。
③晶胞中含有P原子数为8×1/8+6×1/2=4,Al原子数也为4,则1mol晶胞的质量为4×(27+31)g=4×58g,晶胞的体积为(5.4635×10-8)3cm3,晶胞密度为![]() ,故答案为:
,故答案为:![]() 。
。