��Ŀ����
����Ŀ��ClO2��һ��ɱ��Ч�ʸߡ�������ȾС��ˮ��������ʵ���ҿ���ͨ�����·�Ӧ�Ƶ�ClO2��2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2+2H2O��
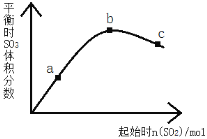
(1)˫���ű�ʾ������ԭ�������ϱ�����ʧ���ӡ������ķ�Ӧ��_______
(2)��1mo KClO3�μӷ�Ӧʱ��_______mol����ת�ơ�
(3)�����ɱ�״���µ�CO2�������44.8L����μӷ�Ӧ�Ļ�ԭ�������ʵ����Ƕ���mol����Ҫ���й淶�Ĺ��̣�_______��
���𰸡� 1 2
1 2
��������
(1)����Ԫ�ػ��ϼ����������ת���뷴Ӧ���͵Ĺ�ϵ����˫���ŷ���ʾ����ת�ƣ�
(2)����Ԫ�ػ��ϼ۱仯��Ŀ���ڷ�Ӧ�����е���ת����Ŀ���㣻
(3)�ȼ���CO2�����ʵ��������ݷ�Ӧǰ��Ԫ�ػ��ϼ۱仯��Ŀ�������ת�ơ�
(1)�ڷ�Ӧ2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2��+2H2O�У�ClԪ�ػ��ϼ��ɷ�ӦǰKClO3�е�+5�۱�Ϊ��Ӧ��ClO2�е�+4�ۣ����ϼ۽��ͣ����2��e-������ԭ��CԪ�ػ��ϼ��ɷ�ӦǰH2C2O4�е�+3�۱�Ϊ��Ӧ��CO2�е�+4�ۣ����ϼ����ߣ�ʧȥ2��e-������������˫���ŷ���ʾ����ת��Ϊ�� ��
��
(2)�ڸ÷�Ӧ��ClԪ�ػ��ϼ��ɷ�ӦǰKClO3�е�+5�۱�Ϊ��Ӧ��ClO2�е�+4�ۣ����ϼ۽���1�ۣ�˵��1mol KClO3�μӷ�Ӧʱ��1mol����ת�ơ�
(3)n(CO2)=44.8L��22.4L/mol=2mol�����ݷ���ʽ��֪��ÿ��1mol��ԭ��H2C2O4������Ӧ����ͬʱ����2molCO2��ת�Ƶ��ӵ����ʵ�����2mol�����ڷ�Ӧ����2molCO2��ת�Ƶ��ӵ����ʵ�����2mol��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�����Ŀ����֪���в������������ý�����ȷ����
ѡ�� | ���������� | ���� |
A | �����������䣬��СH2(g)+I2 (g) | ����ѹǿ��ƽ�������ƶ� |
B | ��������Һ�м��뼸��ϡ���ᣬˮԡ���ȼ����ӣ��������м������Ƶ�������Һ����ˮԡ���ȣ�δ�������� | ����δˮ�� |
C | ������Һ�м���CuSO4��Һ��Na2SO4������Һ����������ɫ���� | �����ʾ������˱��� |
D | ����������ͬʱ��Na2S2O3��Һ��ϡH2SO4��Ӧ��������Һ���¶ȣ��������������ʱ������ | ��������������ʱ�����߷�Ӧ�¶ȣ���ѧ��Ӧ���ʼӿ� |
A. AB. BC. CD. D