题目内容
15.元素周期表是学习化学的重要工具,如图所示为元素周期表的前四周期,现有a-j十种元素在元素周期表中的相对位置如图所示: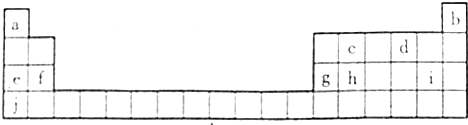
(1)上述元素表格中,元素g的最外层电子数为3;
(2)上述元素中,金属性最强的元素与原子半径最小的元素形成化合物的电子式为K+[:H]-;
(3)最高价氧化物可用于制作光导纤维的元素是Si(填元素符号);
(4)某同学将7.8gf,g的合金投入0.8L的稀硫酸中恰好完全反应,收集到标准状况下的气体8.96L.请计算(写出计算过程):
①合金中各物质的物质的量;
②稀硫酸的物质的量浓度.
分析 由元素在周期表中的位置可知a、b、c、d、e、f、g、h、i、j分别为H、He、C、O、Na、Mg、Al、Si、Cl、K,
(1)g为Al,位于周期表第ⅢA族,可知最外层电子数;
(2)金属性最强的元素与原子半径最小的元素形成化合物为KH;
(3)制作光导纤维的主要原料为二氧化硅;
(4)设Mg为xmol,Al为ymol,根据质量和生成氢气的体积列方程式计算.
解答 解:由元素在周期表中的位置可知a、b、c、d、e、f、g、h、i、j分别为H、He、C、O、Na、Mg、Al、Si、Cl、K,
(1)g为Al,位于周期表第ⅢA族,最外层电子数为3,故答案为:3;
(2)金属性最强的元素与原子半径最小的元素形成化合物为KH,为离子化合物,电子式为K+[:H]-,故答案为:K+[:H]-;
(3)制作光导纤维的主要原料为二氧化硅,对应元素为Si,故答案为:Si;
(4)设Mg为xmol,Al为ymol,涉及反应有Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,
则有$\left\{\begin{array}{l}{24x+27y=7.8}\\{x+\frac{3}{2}y=\frac{8.96}{22.4}}\end{array}\right.$,
x=0.1,y=0.2,
n(H2SO4)=n(H2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,
c(H2SO4)=$\frac{0.4mol}{0.8L}$=0.5mol/L,
答:①合金中Mg的物质的量为0.1mol,Al的物质的量为0.2mol;②稀硫酸的物质的量浓度为0.5mol/L.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置及性质为解答的关键,侧重考查元素化合物性质及化学用语,注重基础知识的夯实,题目难度不大.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 无色无味 | B. | 漂白性 | C. | 还原性 | D. | 会形成酸雨 |
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
 ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )| A. | ①③④⑥⑧ | B. | ②④⑥⑦⑨ | C. | ②③⑤⑦⑧ | D. | ①③⑤⑧ |
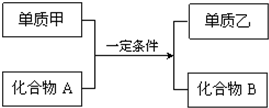 置换反应的通式可表示为:
置换反应的通式可表示为:
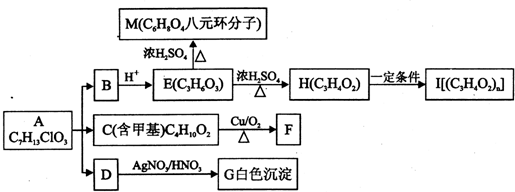
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$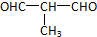 +2H2O.
+2H2O.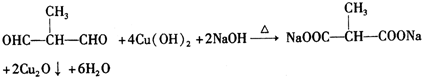 .
.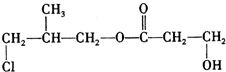
 .
.