题目内容
4.从有机物A开始有如图所示的转化关系(部分产物略去). A在NaOH溶液中水解生成B、C和D,1mol F与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2mol红色沉淀.分析并回答问题: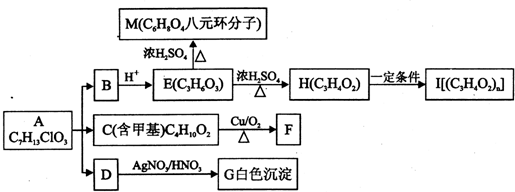
(1)A中含有的官能团有羟基、氯原子、酯基(填写官能团名称)
(2)C的名称(系统命名)是2-甲基-1,3-丙二醇;E-H的反应类型是消去反应;M的核磁共振氢谱有2组峰.
(3)C→F的化学方程式是
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$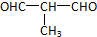 +2H2O.
+2H2O.(4)F与足量新制Cu(OH)2反应的化学方程式是
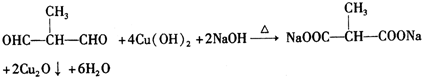 .
.(5)所有满足上述转化关系的A的结构简式是
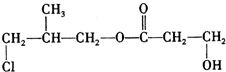
 .
.(6)E的某同系物甲(C4H8O3)有多种同分异构体,其中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上的同分异构体有7种.(不考虑立体异构)
分析 A在NaOH溶液中水解生成B、C和D,发生了酯的水解和卤代烃的水解,B酸化得到E,故E中含有羧基,E转化为H,H在一定条件下反应生成I,反应前后各元素的组成比不变,说明H转化I应为加聚反应,则H中含有C=C,则H为CH2=CHCOOH,I为 ,E发生酯化反应成八元环状化合物生成M,可知E为HOCH2CH2COOH,M为
,E发生酯化反应成八元环状化合物生成M,可知E为HOCH2CH2COOH,M为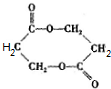 ,B为HOCH2CH2COONa,A在碱性条件下生成HOCH2CH2COONa、NaCl和C,D与硝酸银、硝酸反应得到白色沉淀G,故D为NaCl,G为AgCl.C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF(C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为
,B为HOCH2CH2COONa,A在碱性条件下生成HOCH2CH2COONa、NaCl和C,D与硝酸银、硝酸反应得到白色沉淀G,故D为NaCl,G为AgCl.C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF(C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C为 ,F
,F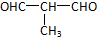 ,所以有机物A为
,所以有机物A为 或
或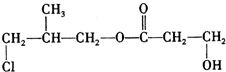 .
.
(1)根据A的结构简式进行分析所含官能团;
(2)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;E-H的反应为醇的消去反应;根据有机物分子中有几种H原子,核磁共振氢谱有几种吸收峰,结合等效氢判断;
(3)C→F为醇在催化剂的作用下发生氧化反应生成醛和水;
(4)F为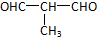 ,与氢氧化铜发生氧化反应,醛基被氧化成羧基,据此书写方程式;
,与氢氧化铜发生氧化反应,醛基被氧化成羧基,据此书写方程式;
(5)根据A的转化结合A的分子式判断结构简式;
(6)根据E为HOCH2CH2COOH,有机物甲(C4H8O3)结构中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上为条件书写同分异构体.
解答 解:A在NaOH溶液中水解生成B、C和D,发生了酯的水解和卤代烃的水解,B酸化得到E,故E中含有羧基,E转化为H,H在一定条件下反应生成I,反应前后各元素的组成比不变,说明H转化I应为加聚反应,则H中含有C=C,则H为CH2=CHCOOH,I为 ,E发生酯化反应成八元环状化合物生成M,可知E为HOCH2CH2COOH,M为
,E发生酯化反应成八元环状化合物生成M,可知E为HOCH2CH2COOH,M为 ,B为HOCH2CH2COONa,A在碱性条件下生成HOCH2CH2COONa、NaCl和C,D与硝酸银、硝酸反应得到白色沉淀G,故D为NaCl,G为AgCl.C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF(C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C
,B为HOCH2CH2COONa,A在碱性条件下生成HOCH2CH2COONa、NaCl和C,D与硝酸银、硝酸反应得到白色沉淀G,故D为NaCl,G为AgCl.C的分子式为C4H10O2,分子中含有甲基,由C催化氧化生成F(C4H6O2),1molF(C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O,则F分子中含有2个-CHO,故C ,F
,F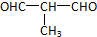 ,所以有机物A为
,所以有机物A为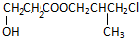 或
或 ,
,
(1)由上述分析可知,A为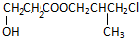 或
或 ,含有官能团为:酯基-COOC-、羟基-OH、氯原子-Cl,
,含有官能团为:酯基-COOC-、羟基-OH、氯原子-Cl,
故答案为:氯原子、酯基;
(2)C为 ,含有羟基的最长碳链为3,在2号碳上含有1个甲基,在1、3号碳上分别含有1个醇羟基,系统命名为:2-甲基-1,3-丙二醇,
,含有羟基的最长碳链为3,在2号碳上含有1个甲基,在1、3号碳上分别含有1个醇羟基,系统命名为:2-甲基-1,3-丙二醇,
E→H的反应方程式为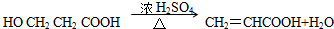 ,该反应为醇的消去反应,
,该反应为醇的消去反应,
M为 ,M中有2种氢原子,核磁共振氢谱中有2种峰,
,M中有2种氢原子,核磁共振氢谱中有2种峰,
故答案为:2-甲基-1,3-丙二醇;消去反应;2;
(3)C→F的反应方程式为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$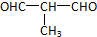 +2H2O,
+2H2O,
故答案为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$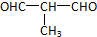 +2H2O;
+2H2O;
(4)氢氧化铜中+2价铜具有氧化性,能氧化醛基生成羧基,F为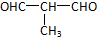 ,与氢氧化铜发生氧化反应
,与氢氧化铜发生氧化反应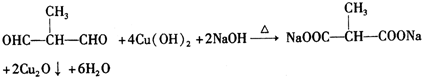 ,
,
故答案为: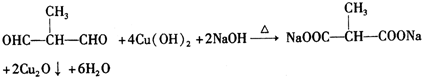 ;
;
(5)A的分子式为C7H13ClO3,A在碱性条件下生成HOCH2CH2COONa、NaCl和 ,所以满足上述转化关系的A的结构简式可以是:
,所以满足上述转化关系的A的结构简式可以是: 、
、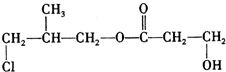 ,
,
故答案为: 、
、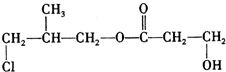 ;
;
(6)E为HOCH2CH2COOH,与E含有相同官能团的某有机物甲(C4H8O3)有多种同分异构体,在结构中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上的同分异构体有HOCH2CH2COOCH3、CH3CH(0H)COOCH3、CH3COOCH2CH20H、HOCH2COOCH2CH3、HCOOCH2CH(0H)CH3、HCOOCH2CH2CH2OH、HCOOCH(CH3)CH2OH,共7种
故答案为:7.
点评 本题考查有机物的推断、官能团、有机反应类型等,注意结合有机物的分子式进行推断,需要学生熟练掌握官能团的性质与转化,题目难度中等.

| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| A. | FeCl2 | B. | KHCO3 | C. | MgSO4 | D. | NH4HCO3 |
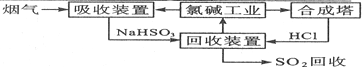
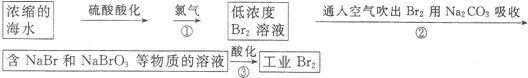
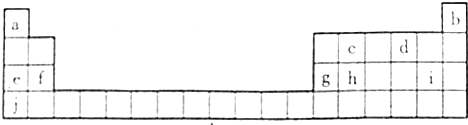
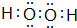 .
.