题目内容
7.${\;}_{\;}^{37}$Cl、${\;}_{\;}^{35}$Cl为不同的核素,下列说法正确的是( )| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
分析 A.摩尔质量的单位是g/mol;
B.根据氯气的价态判断氯气的性质,处于中间价态的物质既有氧化性又有还原性;
C.根据n=$\frac{m}{M}$计算,1molCl2含有34mol电子;
D.常温下,气体的摩尔体积大于22.4L/mol;
解答 解:A.${\;}_{\;}^{37}$Cl2的摩尔质量是74g/mol,故A错误;
B.氯气具有强氧化性,通常情况下,氯气做氧化剂,氯气中氯元素的化合价是0价,处于中间价态,所以既有氧化性又有还原性,如氯气和水反应Cl2+H2O?HCl+HClO,故B正确;
C.根据n=$\frac{m}{M}$=$\frac{35g}{70g/mol}$=0.5mol,1molCl2含有34mol电子,0.5molCl2含有17mol电子,故C正确;
D.常温下,4.48L ${\;}_{\;}^{37}$Cl2含物质的量小于0.2mol,所以含有中子数小于8NA个,故D错误;
故选BC.
点评 本题考查了物理量的单位、微粒的电子数、元素性质与化合价的关系等知识点,易错选项是D,注意有关气体体积的计算与温度和压强有关,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,44gCO2中含有的氧原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA |
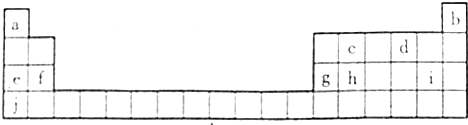
18.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | X的阴离子比Y的阴离子离子半径大 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
16. 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
19.下列变化过程需加入氧化剂的是( )
| A. | HCl→H2 | B. | Mg→Mg2+ | C. | Cl-→AgCl | D. | CuO→Cu |