题目内容
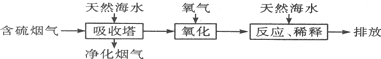
5.二氧化硫不具有的性质是( )| A. | 无色无味 | B. | 漂白性 | C. | 还原性 | D. | 会形成酸雨 |
分析 二氧化硫为酸性氧化物,可与水、碱以及碱性氧化物反应,S元素化合价为+4价,处于中间价态,既具有氧化性也具有还原性,另外还具有漂白性,以此解答.
解答 解:二氧化硫为无色、具有刺激性气味的气体,可与水、碱以及碱性氧化物反应,具有漂白性、氧化性和还原性,可形成酸雨,只有A错误.
故选A.
点评 本题考查二氧化硫的性质,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA | |
| C. | 2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
13.下列实验方法或实验叙述正确的是( )
| A. | 将pH试纸直接放入某溶液中,测定该溶液的pH | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| D. | 从碘水提取碘可用乙醇作萃取剂 |
20.某原电池装置图如图所示,有关该原电池的说法正确的是( )
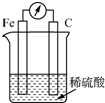

| A. | 在铁棒上产生气泡,碳棒上没有气泡 | |
| B. | H+在溶液中定向流向铁 | |
| C. | 电子由铁电极流出 | |
| D. | 该装置能将电能转化为化学能 |
10.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 生石灰-Ca(OH)2 | B. | 醋酸-C2H4O2 | C. | 石膏-2CaSO4•H2O | D. | 小苏打-KHCO3 |
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,44gCO2中含有的氧原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA |
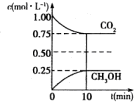 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.