题目内容
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
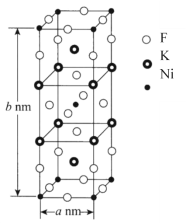
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
【答案】s A 基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”) NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl O CX4、SiX4(X表示卤素原子,任写一种) 28NA 四面体形 sp3 sp3 ![]()
【解析】
(1)K元素的价电子排布式为4s1,最后的电子排在s轨道上,所以处于元素同期表的s区。
答案为s;
(2)在第三周期,轨道的能量3s<3p,电子的能量越低,电离时消耗的能量越高,所以3s轨道上的电子电离时消耗的能量最高。答案为A;
(3)从核外电子排布角度看,基态Cu+的价电子排布式为3d10,为全充满状态,更稳定。
答案为:基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”)
(4)从表中可以看出,KCl、NaCl的熔点相近,而SiO2的熔点高。因为NaCl、KCl为离子晶体,SiO2为原子晶体,所以SiO2的熔点高;K+半径大于Na+半径,晶格能NaCl >KCl,所以NaCl的熔点高。
答案为:NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
① N、O、S三种元素中电负性最大的是O。答案为O
② [Ni(NH3)6]SO4中的阴离子为SO42-,它的价电子数为42,与它互为等电子体的分子为CX4、SiX4(X表示卤素原子,任写一种)。答案为CX4、SiX4(X表示卤素原子,任写一种)
③在[Ni(NH3)6]SO4中,[Ni(NH3)6]2+含有24个δ键,SO42-中含有4个δ键。所以1mol[Ni(NH3)6]SO4中含有δ键的数目为28NA。答案为28NA
④NH3的VSEPR模型为四面体。答案为四面体形
NH3的中心原子的杂化类型sp3,答案为sp3。
SO42-的中心原子的杂化类型为sp3,答案为sp3。
(6)从K、Ni、F三种元素组成的一种晶体的长方体晶胞结构图,我们可以得出该物质的化学式为K4Ni2F8,它的相对分子质量为426,则该晶体的密度
ρ= ![]() ×1023g·cm-3。答案为:
×1023g·cm-3。答案为:![]() 。
。

【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
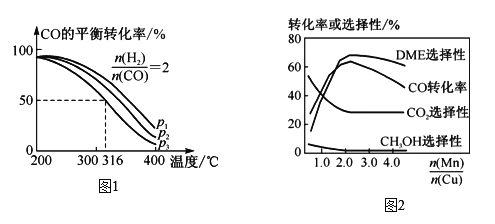
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。
【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。
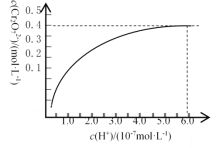
②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
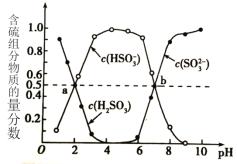
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
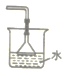
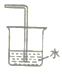
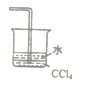
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
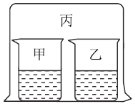
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
【题目】(1)如图为某原子3d能级的电子排布情况.
![]()
该排布情况违反了________原理
(2)s电子的原子轨道呈_________形,每个s能级有_________个原子轨道;p电子的原子轨道_________形,每个p能级有_________个原子轨道。
(3)填表
分子或离子 | CO2 | H2O | SO3 | NH4+ | N2O |
VSEPR模型名称 | ____ | _____ | ____ | ____ | _____ |
中心原子杂化轨道类型 | ____ | ____ | ____ | ____ | ____ |
分子或离子立体构型 | ___ | ___ | ___ | ___ | ___ |