题目内容
【题目】下图为几种晶体或晶胞的示意图:
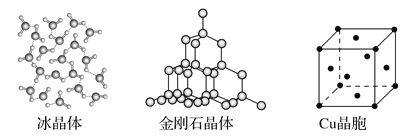
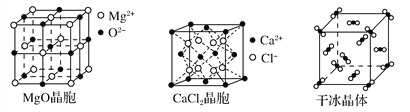
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
【答案】 金刚石晶体 金刚石>MgO>CaCl2>冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-) 4 8 H2O分子之间能形成氢键
【解析】本题主要考查晶体结构。
(1)上述晶体中,粒子之间以共价键结合形成的晶体是属于原子晶体的金刚石晶体。
(2)一般地,熔点:原子晶体>离子晶体>分子之间形成氢键的分子晶体>不存在氢键的分子晶体,离子晶体中的离子半径越小、离子所带电荷越多,离子晶体的熔点越高,所以冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为金刚石>MgO>CaCl2>冰>干冰。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能小于MgO晶体,原因是MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)。
(4)每个Cu晶胞中实际占有4个Cu原子,CaCl2晶体中Ca2+的配位数为8。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是H2O分子之间能形成氢键。

【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1

