题目内容
【题目】(1)如图为某原子3d能级的电子排布情况.
![]()
该排布情况违反了________原理
(2)s电子的原子轨道呈_________形,每个s能级有_________个原子轨道;p电子的原子轨道_________形,每个p能级有_________个原子轨道。
(3)填表
分子或离子 | CO2 | H2O | SO3 | NH4+ | N2O |
VSEPR模型名称 | ____ | _____ | ____ | ____ | _____ |
中心原子杂化轨道类型 | ____ | ____ | ____ | ____ | ____ |
分子或离子立体构型 | ___ | ___ | ___ | ___ | ___ |
【答案】泡利 球 1 哑铃 3 直线 四面体 平面三角形 正四面体 直线 SP SP3 SP2 SP3 SP 直线 V形 平面三角形 正四面体 直线
【解析】
(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,同一个原子轨道中不应有自旋状态相同的电子,所以违反了泡利原理,故答案为:泡利。
(2)s电子的原子轨道呈球形,每个s能级有1个原子轨道;p电子的原子轨道呈哑铃形,每个p能级有3个原子轨道,故答案为:球,1,哑铃,3。
(3)根据价层电子对互斥理论可知,CO2的中心原子是C,孤对电子对数=![]() =0,σ键电子对数为2,价电子对数=0+2=2,所以其VSEPR模型为直线形,立体构型为直线形,中心原子C原子杂化轨道类型为sp杂化;H2O的中心原子是O,孤对电子对数=
=0,σ键电子对数为2,价电子对数=0+2=2,所以其VSEPR模型为直线形,立体构型为直线形,中心原子C原子杂化轨道类型为sp杂化;H2O的中心原子是O,孤对电子对数=![]() =2,σ键电子对数为2,价电子对数=2+2=4,所以其VSEPR模型为四面体形,立体构型为V形,中心原子O原子杂化轨道类型为sp3杂化;SO3的中心原子是S,孤对电子对数=
=2,σ键电子对数为2,价电子对数=2+2=4,所以其VSEPR模型为四面体形,立体构型为V形,中心原子O原子杂化轨道类型为sp3杂化;SO3的中心原子是S,孤对电子对数=![]() =0,σ键电子对数为3,价电子对数=0+3=3,所以其VSEPR模型为平面三角形,立体构型为平面三角形,中心原子S原子杂化轨道类型为sp2杂化;NH4+的中心原子是N,孤对电子对数=
=0,σ键电子对数为3,价电子对数=0+3=3,所以其VSEPR模型为平面三角形,立体构型为平面三角形,中心原子S原子杂化轨道类型为sp2杂化;NH4+的中心原子是N,孤对电子对数=![]() =0,σ键电子对数为4,价电子对数=0+4=4,所以其VSEPR模型为正四面体形,立体构型为正四面体形,中心原子N原子杂化轨道类型为sp3杂化;N2O的中心原子是N,孤对电子对数=
=0,σ键电子对数为4,价电子对数=0+4=4,所以其VSEPR模型为正四面体形,立体构型为正四面体形,中心原子N原子杂化轨道类型为sp3杂化;N2O的中心原子是N,孤对电子对数=![]() =0,σ键电子对数为2,价电子对数=0+2=2,所以其VSEPR模型为直线形,立体构型为直线形,中心原子N原子杂化轨道类型为sp杂化;故答案为:直线,四面体,平面三角形,正四面体,直线,sp,sp3,sp2,sp3,sp,直线,V形,平面三角形,正四面体,直线。
=0,σ键电子对数为2,价电子对数=0+2=2,所以其VSEPR模型为直线形,立体构型为直线形,中心原子N原子杂化轨道类型为sp杂化;故答案为:直线,四面体,平面三角形,正四面体,直线,sp,sp3,sp2,sp3,sp,直线,V形,平面三角形,正四面体,直线。

【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
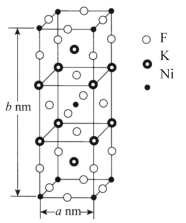
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 第三电子层(最外层 )上有6个电子 |
X | 核内质子数为6 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______。
(2)元素Y与氢元素形成一种离子![]() ,写出该微粒的化学式:____(用元素符号表示)。
,写出该微粒的化学式:____(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是____(用元素符号表示 ),下列表述中能证明这一事实的是____(填序号 )。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4 )探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填化学式 ),理由是____________。Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为____。