题目内容
【题目】氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:![]()
![]()
![]()
(1)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是_____。
A.  B.
B.  C.
C.  D.
D. 
(2)某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。写出该反应的平衡常数表达式_______。若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是_____(填字母代号)。
A. 压缩容器体积 B. 适当升高温度 C. 通入适量氮气 D. 加适量催化剂
(3)能说明上述反应达到平衡状态的是____________
A. ![]() B. 混合气体的密度不再改变
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变 D. 单位时间内生成n mol N2 的同时生成2n mol NH3
(4)氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),
![]() 的电离程度______,溶液的pH值_____。
的电离程度______,溶液的pH值_____。
氨气与酸反应得到铵盐,某![]() 水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
【答案】B K=![]() AC CD 增大 减小 NH4++H2O
AC CD 增大 减小 NH4++H2O![]() NH3
NH3![]() H2O+H+ 1.8×10-7
H2O+H+ 1.8×10-7
【解析】
(1)氨气极易溶于水,直接用水吸收,能够发生倒吸现象,所以吸收氨气时所选装置必须具有防止倒吸的作用;
(2)根据平衡常数K的定义列出表达式;若要增大反应速率,且平衡向正反应方向移动,加压、增加反应物浓度均可;
(3)反应达到平衡状态,正逆反应速率相等,各组分浓度不变;
(4)氨水溶液加水稀释后,促进电离,电离程度增大,电离常数只与温度有关,稀释氢氧根离子浓度减小;
(5)NH4+水解导致硫酸铵溶液显酸性,氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,若硫酸剩余,抑制水的电离,若硫酸反应完全,促进水的电离。
(1)A. 倒扣的漏斗使NH3充分吸收同时防止倒吸现象的发生,A项错误;
B. 由于NH3易溶于水,可发生倒吸现象,不能够用水直接吸收,B项正确;
C. 由于NH3难溶于CCl4,NH3与CCl4接触不易发生倒吸现象,能够用于吸收氨气,C项错误;
D. 由于干燥管的上部大,能够防止倒吸现象的发生,D项错误;
故答案为:B;
(2)合成氨反应为![]()
![]()
![]() ,则平衡常数K表示生成物的浓度幂之积与反应物的浓度幂之积的比值,其表达式为:K=
,则平衡常数K表示生成物的浓度幂之积与反应物的浓度幂之积的比值,其表达式为:K=![]() ;
;
若要增大反应速率,且平衡向正反应方向移动,加压、增加反应物浓度均可,
A.压缩容器体积,压强增大,反应速率增大,平衡正向移动,A项正确;
B.适当升高温度,平衡逆向移动,B项错误;
C.通入适量氮气,反应物浓度增大,反应速率增大,平衡正向移动,C项正确;
D.加适量催化剂,平衡不移动,D项错误;
故选AC,
故答案为:K=![]() ;AC;
;AC;
(3)对于反应N2+3H22NH3
A.任何状态下,υ (H2):υ(NH3)=3;2,A项错误;
B.若容器体积不变,而混合气体质量不变,则混合气体的密度不变,B项错误;
C.反应为气体体积减小的反应,而混合气体质量不变,若混合气体的平均相对分子质量不再改变,说明反应达到平衡状态,C项正确;
D.单位时间内生成n mol N2的同时生成2n mol NH3,说明正逆反应速率相等,D项正确;
故答案为:CD;
(4)氨水溶液加水稀释后,促进电离,电离程度增大;稀释后,溶液中的氢氧根离子浓度减小,pH值减小,故答案为:增大;减小;
(5)NH4+水解导致硫酸铵溶液显酸性,水解方程式为NH4++H2ONH3H2O+H+,某(NH4)2SO4水溶液的pH=5,溶液中c(H+)=10-5mol/L,氢离子源于水的电离,假设溶液为1L,溶液中n(H+)=10-5mol,则发生电离的水为10-5mol,稀溶液可以近似为水,水的质量约是1000g,其物质的量为![]() =
=![]() mol,水的电离度为
mol,水的电离度为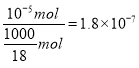 ,
,
故答案为:NH4++H2ONH3H2O+H+;1.8×10-7。

【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
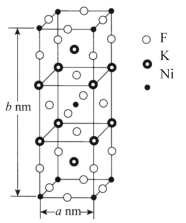
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。