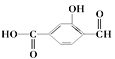
题目内容
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
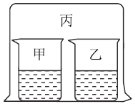
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
【答案】D
【解析】
A.甲烧杯中浓盐酸挥发出HCl,HCl和乙烧杯中的硝酸银溶液反应生成氯化银白色沉淀,故A正确;
B. 甲烧杯中浓氨水挥发出NH3,NH3和乙烧杯中的硫酸铁溶液反应生成氢氧化铁红褐色沉淀,故B正确;
C. 甲烧杯中浓盐酸挥发出HCl,乙烧杯中浓氨水挥发出NH3,HCl和NH3反应生成氯化铵,丙中产生白色烟雾,故C正确;
D. 乙烧杯中浓氨水加入固体氢氧化钠产生NH3,NH3和甲烧杯中的氯化铝溶液反应生成氢氧化铝白色沉淀,但氢氧化铝不溶于氨水,故D错误。
故答案选D。

【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
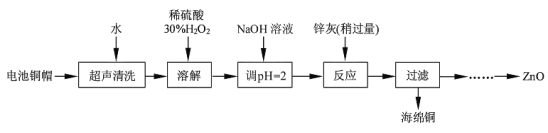
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式____;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为____,滴定终点观察到的现象为___;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为____(结果保留四位有效数字),若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会____(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。计算沉淀生成的溶液的pH= ___(假设Cu2+被完全沉淀,混合后溶液体积不发生变化);
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入适量30% H2O2,使其充分反应;
②_______;
③过滤;
④______;
⑤过滤、洗涤、干燥;
⑥900℃煅烧。
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
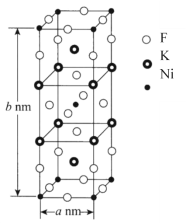
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。