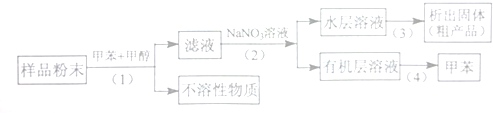
题目内容
6.下列有关溶液的叙述正确的是( )| A. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-可以大量共存 | |
| B. | 0.1mol•L-1氨水:K+、Na+、NO3-、AlO2-可以大量共存 | |
| C. | 向(CH3COO)2Ba溶液中加入硫酸发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| D. | 已知K${\;}_{{a}_{1}}$(H2CO3)>Ka(HClO)>K${\;}_{{a}_{2}}$(H2CO3),向NaClO溶液中通入少量的CO2,发生反应的离子方程式为:CO2+2ClO-+H2O═CO32-+2HClO |
分析 A.离子之间发生氧化还原反应;
B.氨水溶液显碱性;
C.漏写生成醋酸的离子反应;
D.Ka越大,酸性越强,向NaClO溶液中通入少量的CO2,发生强酸制取弱酸的反应,生成HClO和碳酸氢钠.
解答 解:A.0.1mol•L-1 Fe(NO3)2溶液中,H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.0.1mol•L-1氨水中,该组离子之间不反应,可以大量共存,故B制取;
C.向(CH3COO)2Ba溶液中加入硫酸发生反应的离子方程式为2CH3COO-+2H++Ba2++SO42-═BaSO4↓+2CH3COOH,故C错误;
D.由Ka可知,向NaClO溶液中通入少量的CO2,发生反应的离子方程式为CO2+ClO-+H2O═HCO3-+HClO,故D错误;
故选B.
点评 本题考查离子共存及离子反应,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的考查,题目难度不大.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
17.下列说法中,正确的是( )
| A. | 丙烯的结构简式可以表示为CH3CHCH2 | |
| B. | 用酒精可以将溴水中的溴萃取出来 | |
| C. | 乙烷、乙醇和乙酸都能发生取代反应 | |
| D. | 油脂都不能使酸性高锰酸钾溶液褪色 |
14.将1L乙烷在100L空气中充分燃烧,反应后混合气体经浓硫酸干燥后,剩余气体的体积为(气体体积在相同条件下测定)( )
| A. | 93.5L | B. | 95L | C. | 97.5L | D. | 98.5L |
11.分子式为C7H8,且分子中含有苯环的烃的一氯代物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
1.下列物质的类别与所含官能团都正确的是( )
| A. | 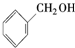 酚类-OH 酚类-OH | B. | 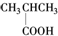 羧酸-COOH 羧酸-COOH | ||
| C. | 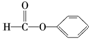 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类-CHO |
18.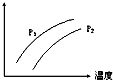 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
19.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从下口放出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线 | |
| C. | 用淘洗的方法从沙里淘金 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.