题目内容
5.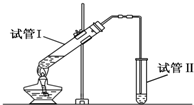 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.①写出制备乙酸乙酯的化学方程式CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
②试管Ⅱ中盛的试剂是饱和Na2CO3溶液.
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液
(2)已知乳酸的结构简式为
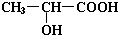 .试回答:
.试回答:①乳酸分子中含有羟基和羧基两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为
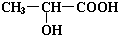 +2Na→
+2Na→ +H2↑.
+H2↑.
分析 (1)实验室制备乙酸乙酯用乙醇和乙酸在浓硫酸作催化剂条件下加热反应生成,用饱和碳酸钠溶液吸收,分离互不相溶的液体,可用分液的方法分离,以此解答该题;
(2)根据结构简式来寻找出现的官能团;醇和羧酸均能和金属钠发生置换反应生成氢气.
解答 解:(1)①实验室制备乙酸乙酯用乙醇和乙酸在浓硫酸作催化剂条件下加热反应生成,反应的方程式为CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
②实验室用饱和碳酸钠溶液吸收,因乙酸乙酯不溶于饱和碳酸钠溶液,且饱和碳酸钠溶液可起到除去乙酸和乙醇的作用,故答案为:饱和Na2CO3溶液;
③分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,故答案为:分液;
(2)①根据乳酸的结构简式可以看出其中含有的官能团为:羟基,羧基,故答案为:羟基;羧基;
②乳酸中的醇羟基和羧基均与金属钠反应,反应的化学方程式为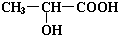 +2Na→
+2Na→ +H2↑,
+H2↑,
故答案为: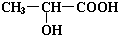 +2Na→
+2Na→ +H2↑.
+H2↑.
点评 本题考查有机物的性质以及化学方程式的书写知识,注意官能团对物质性质的决定作用,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.哈伯因发明用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2?2NH3.下列说法正确的是( )
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| C. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 | |
| D. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 |
13.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| B. | 乙烯能发生加成反应而乙烷不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
20.下列反应中,属于加成反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴水褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色变浅 |
10.生活中金属的使用已成为一种日常,在生活中使用的金属中,除少量极不活泼金属外几乎所有的金属都以化合态存在,那么我们的问题来了,请问下列各种冶炼方法中,可制得相应金属的是( )
| A. | 加热氧化银 | B. | 煅烧碳酸钙 | ||
| C. | 电解氯化钠溶液 | D. | 氯化镁与铝粉高温共热 |
17.下列说法中,正确的是( )
| A. | 丙烯的结构简式可以表示为CH3CHCH2 | |
| B. | 用酒精可以将溴水中的溴萃取出来 | |
| C. | 乙烷、乙醇和乙酸都能发生取代反应 | |
| D. | 油脂都不能使酸性高锰酸钾溶液褪色 |
14.将1L乙烷在100L空气中充分燃烧,反应后混合气体经浓硫酸干燥后,剩余气体的体积为(气体体积在相同条件下测定)( )
| A. | 93.5L | B. | 95L | C. | 97.5L | D. | 98.5L |
18.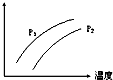 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.