题目内容
8.由N2和H2组成的混合气体,其平均相对分子质量为12.4,取此混合气体0.5mol充入密闭容器中,使之反应并在一定条件下达到平衡.已知反应达到平衡后容器内压强是相同条件下反应前压强的0.8倍,求:(1)反应前混合气体中N2和H2的体积比;
(2)平衡混合气体中NH3和H2的物质的量;
(3)达到平衡时转化的N2占起始N2的百分比.
分析 N2和 H2按一定比例混合,设氮气为xmol,氢气为ymol,则$\frac{28x+2y}{x+y}$=12.4,解得x:y=2:3,混合气体0.5mol,则N2和 H2的物质的量分别为0.2mol、0.3mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.2 0.3 0
转化(mol):n 3n 2n
平衡(mol):0.2-n 0.3-3n 2n
达到平衡后容器内压强是相同条件下反应前压强的0.8倍,则(0.5-2n)=0.5×0.8,解得n=0.05mol,据此解答.
解答 解:(1)N2和 H2按一定比例混合,设氮气为xmol,氢气为ymol,则$\frac{28x+2y}{x+y}$=12.4,解得x:y=2:3,相同条件下物质的量之比等于体积之比,反应前混合气体中N2和H2的体积比为2:3,
答:反应前混合气体中N2和H2的体积比为2:3.
(2)混合气体共0.5mol,则N2和 H2的物质的量分别为0.2mol、0.3mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.2 0.3 0
转化(mol):n 3n 2n
平衡(mol):0.2-n 0.3-3n 2n
达到平衡后容器内压强是相同条件下反应前压强的0.8倍,则(0.5-2n)=0.5×0.8,解得n=0.05,
平衡混合气体中,NH3的物质的量为0.05mol×2=0.1mol,H2的物质的量0.3mol-0.05mol×3=0.15mol,
答:平衡混合气体中NH3和H2的物质的量分别为0.1mol、0.15mol.
(3)平衡时氮气的转化率为$\frac{0.05mol}{0.2mol}$×100%=25%,
故:达到平衡时转化的N2占起始N2的百分比为25%.
点评 本题考查化学平衡的计算,难度不大,注意掌握三段式在化学平衡计算中的应用.

 阅读快车系列答案
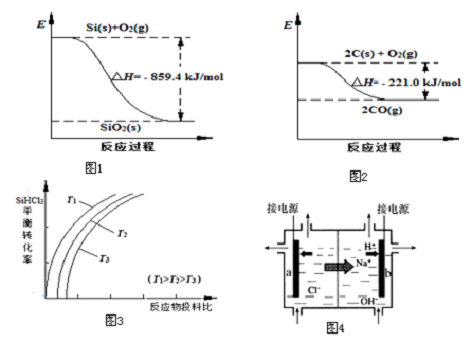
阅读快车系列答案(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用蒸馏(或分馏)方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是ac(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是精制的饱和食盐水,b电极上的电极反应式是2H++2e-═H2↑.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=4.
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
| A. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存 | |
| C. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+A12O3 |
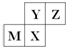
| A. | 四种元素中,最高价氧化物的水化物酸性:Z的最强 | |
| B. | 氢化物稳定性:Y的最强 | |
| C. | 原子半径由小到大顺序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失电子最多,其单质的还原性最强 |
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
