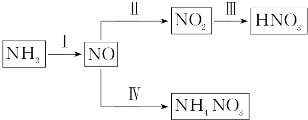
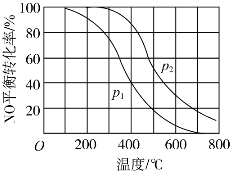
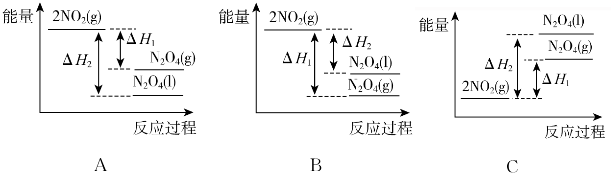
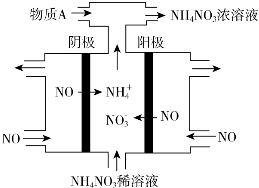
题目内容
18.下列实验操作或事实与预期实验目的或所得结论对应正确的是( )| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.红褐色沉淀为氢氧化铁,但淡黄色试液一定含铁离子,可能含亚铁离子;
B.沉淀向溶度积小的方向转化;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡;
D.NaOH足量,生成的Na2HPO3为正盐.
解答 解:A.红褐色沉淀为氢氧化铁,但淡黄色试液可能含亚铁离子和铁离子,则原溶液中不一定含所有FeCl3,故A错误;
B.白色Mg(OH)2 转化为蓝色Cu(OH)2,说明Mg(OH)2的溶度积大于Cu(OH)2,故B正确;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡,不能说明是否含SO42-,故C错误;
D.NaOH足量,生成的Na2HPO3为正盐,则H3PO3属于二元酸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、沉淀转化、氧化还原反应等,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
13.主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法错误的是( )
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
7.(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
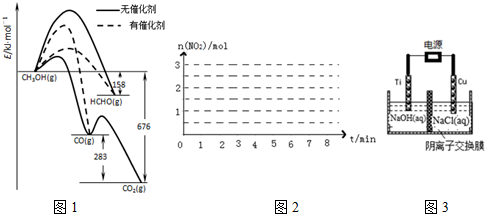
①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图2.计算该温度下反应的平衡常数K(保留2位有效数字,写出计算过程).
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.

①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
3.常温下,下列有关溶液的叙述正确的是( )
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |