题目内容
3.设NA代表阿佛加德罗常数,下列说法中正确的是( )| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
分析 A、氦气是单原子分子,原子序数为2;
B、14C的中子数为14-6=8,H的中子数为0,故-14CH3的中子数为8,据此解答;
C、丙烷分子中含有8个碳氢键、2个碳碳键,总共含有10个共价键;
D、乙酸是弱电解质,在溶液中部分电离.
解答 解:A、常温常压下,氦气是单原子分子,1mol氦气含有的核外电子数为2NA,故A错误;
B、14C的中子数为14-6=8,H的中子数是0,故-14CH3的中子数为8,17g甲基(-14CH3)的物质的量为1mol,故所含的中子数为8NA,故B正确;
C、0.44g丙烷的物质的量为:$\frac{0.44g}{44g/mol}$=0.01mol,1mol丙烷分子中含有2mol碳碳键、8mol碳氢键,总共含有10mol共价键,含有的共用电子对数目为10NA,故0.01mol丙烷中含0.1mol共用电子对,即0.1NA个,故C错误;
D、乙酸是弱电解质,在溶液中部分电离,故溶液中含有的乙酸分子数目小于0.05NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 容量瓶、分液漏斗、滴定管在使用前都需要检查是否漏水,可以用相同的实验方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的$\frac{1}{2}$ | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 将灼烧后的海带灰加水煮沸2-3分钟的目的是加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液 |
14.欲将AlCl3溶液中的铝离子沉淀完全,最合适的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | NaCl溶液 |
18.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 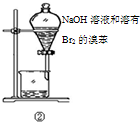 | C. | 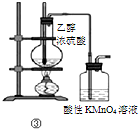 | D. |  |
15.在常温条件下,下列对醋酸的叙述中,不正确的是( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{{cCH}_{3}COOH}{{cH}^{+}}$变小 | |
| C. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-) | |
| D. |  向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL |
13.主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法错误的是( )
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |

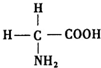 氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.
氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.