题目内容
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下: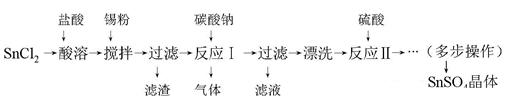
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
(1)加入盐酸,使水解平衡向左移动,抑制Sn2+水解
(2)防止Sn2+被氧化
(3)取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净
(4)加热浓缩、冷却结晶、过滤、洗涤
(5)Sn2+ + H2O2 +2H+=Sn4+ +2H2O
(6)93.18%
解析试题分析:(1)SnCl2在水中发生水解反应:SnCl2+H2O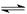 Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
(2)由于在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。为了调节调节溶液pH并防止Sn2+被氧化为Sn4+要加入Sn粉。
(3)在反应过程中加入了HCl,沉淀的表面会有Cl-存在,只要能证明在洗涤液中无Cl-存在就可以证明沉淀已经洗涤完全。具体的检验方法是取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净。
(4)在多步操作中所包含的具体实验步骤的名称是加热浓缩、冷却结晶、过滤、洗涤。
(5)酸性条件下,SnSO4与双氧水发生反应的离子方程式是Sn2+ + H2O2 +2H+=Sn4+ +2H2O。
(6)在处理过程中发生的反应为:Sn + 2HCl=SnCl2 + H2↑;2FeCl3+SnCl2=2FeCl2+ SnCl4
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。由方程式得关系式3Sn—3SnCl2 —6FeCl3 — K2Cr2O7.因为n(K2Cr2O7)="C·V=0.1000" mol/L×0.032L=3.2×10-3mol.所以n(Sn)= 3×3.2×10-3mol ="9.6" × 10-3mol.m(Sn)=n·M=9。6×10-3mol×119g/mol=1.14g.该锡粉样品中锡的质量分数是(1.14g÷1. 226 g) ×100%=93.18%.
考点:考查在电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等有重要作用的SnSO4制备、性质反应原理等的知识。

(15分)
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
② 过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③ 除去Mg2+的离子方程式是______。
④ 检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是______。
③ 过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______。
实验室用NaOH固体配制0.1 000mol·L-1NaOH溶液500mL.
(1)用托盘天平称取NaOH固体________g.溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是________ (填仪器选项符号)
A.玻璃棒 B.胶头滴管 C.烧杯 D.500mL容量瓶
(2)用所配制的0.1000mol·L-1NaOH溶液通过中和滴定测定一元弱酸HA溶液浓度,每次滴定取用的HA溶液均为20.00mL,使用酚酞溶液为指示剂,滴定终点的标志是____________________________。滴定的实验数据记录:
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
处理以上实验数据,测得该HA溶液物质的量浓度为____________________。
(3)上述中和滴定实验中,以下操作可能导致所测溶液浓度偏高的是__________(填选项符号)
A.滴定管用待装液润洗
B.锥形瓶用待装液润洗
C.滴定前滴定管末端气泡没赶尽
D.滴定前平视观察读数,滴定后俯视观察读数
E.所用的标准液(NaOH溶液)浓度偏高
(4)用pH计测得该HA溶液pH=a,结合上述中和滴定结果可推算实验温度下HA的Ka=________。
现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯(若干) ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
下列药品:
| A.NaOH固体 | B.标准NaOH溶液 | C.未知浓度盐酸 | D.蒸馏水(E)碳酸钠溶液 |
(1)过滤时,应选用的上述仪器是 (填编号)。
(2)配制250ml一定物质的量浓度的NaOH溶液时,还缺少的仪器是 。
(3)做酸碱中和滴定时,还缺乏的试剂是 。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的 (填编号)。
甲.酸式滴定管 乙.碱式滴定管 丙.25 mL量筒 丁.锥形瓶
(5)某同学用一份已知浓度的盐酸溶液滴定未知浓度的NaOH溶液,下列操作对滴定的结果有什么影响?(填“偏大”、“偏小”或“无影响”)
①酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗。_____________
②滴定前,滴定管尖端有气泡,滴定后气泡消失。_____________
③读酸式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数。_______
④滴定到终点附近时,向锥形瓶中加入少量蒸馏水冲洗瓶壁上沾的溶液_____
某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: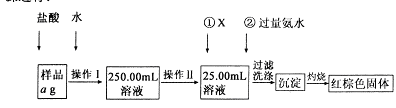
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是 (列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果 (“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示
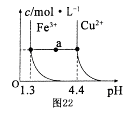 。
。对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
金属M和N可构成如图所示的装置.下列分析正确的是 
| A.金属活泼性N>M |
| B.M逐渐溶解 |
| C.负极反应为2H++2e- =H2↑ |
| D.SO42-向M极定向移动 |
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中正确的是 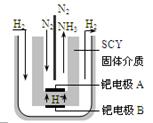
| A.电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B.钯电极B连接的是电源的负极 |
| C.钯电极A的电极反应式为:N2+6e—+6H+==2NH3 |
| D.当有0.3mol电子转移时,有2.688L NH3生成 |
 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度 