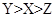题目内容
金属M和N可构成如图所示的装置.下列分析正确的是 
| A.金属活泼性N>M |
| B.M逐渐溶解 |
| C.负极反应为2H++2e- =H2↑ |
| D.SO42-向M极定向移动 |
A
解析试题分析:A、根据图中的电流方向判断M是正极,N是负极,所以N的金属性大于M,正确;B、M是正极,不会溶解,错误;C、负极发生氧化反应,所以是N金属失去电子,错误;D、原电池中阴离子向负极移动,所以硫酸根离子向N极移动,错误,答案选A。
考点:考查原电池反应原理的应用

练习册系列答案
相关题目
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)
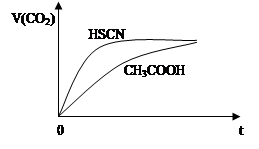
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
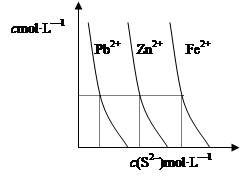
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
某原电池的总反应是Zn+Cu2+====Zn2++Cu,则该原电池的组成正确的是( )
| | A | B | C | D |
| 正极 | Zn | Zn | 碳棒 | Cu |
| 负极 | 碳棒 | Fe | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
原电池产生电流的本质原因是( )
| A.原电池中溶液能电离出自由移动的离子 |
| B.用导线将两个活动性不同的电极连接 |
| C.正极发生了氧化反应,而负极发生了还原反应 |
| D.电极上进行的氧化还原反应中会有电子的转移 |