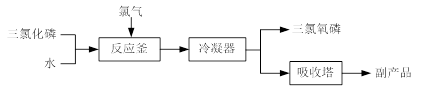
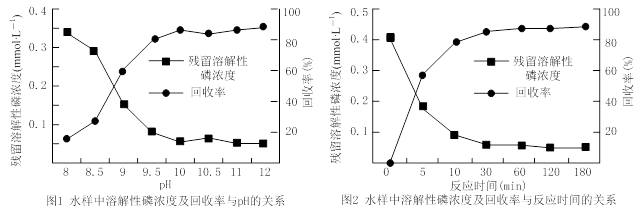
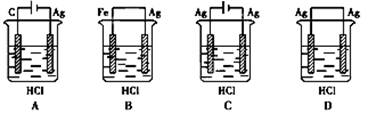
题目内容
(14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
(14分)(每空2分)(1) 碱式滴定管;Na2S2O3溶液呈碱性 (2)防止I—被空气中的氧气氧化(3) 淀粉 ; 溶液恰好由蓝色变成无色,且半分钟内不褪色(4) (cV1-cV2)/40 (5)偏大
解析试题分析:(1)Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性,所以标准Na2S2O3溶液应装入碱式滴定管中;
(2)由于碘离子具有还原性,而空气中含有氧气,氧气能氧化碘离子,所以碘量瓶在震荡静置时要塞紧塞;
(3)由于碘遇淀粉显蓝色,所以滴定时向待测液中加入的指示剂是淀粉,到达滴定终点时的现象为溶液恰好由蓝色变成无色,且半分钟内不褪色;(4)1号瓶消耗V1mL Na2S2O3溶液,2Na2S2O3+I2=2NaI+Na2S4O6可知,20ml溶液中I2和I3-的总物质的量=1/2×V1×10-3L×c mol·L-1=0.5cV1×10-3 mol;2号瓶消耗V2mL Na2S2O3溶液,可知20mL溶液中I2的物质的量=1/2×V2×10-3L×c mol·L-1=0.5cV2×10-3 mol,
故c(I3-)=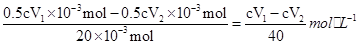 ; (5)如果取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,由c(I3-)=
; (5)如果取上层清液时不小心吸入了少量的I2固体,则1号瓶消耗Na2S2O3溶液的体积增加,由c(I3-)=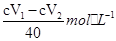 可知,测定结果偏大。
可知,测定结果偏大。
考点:氯、溴、碘及其化合物的综合应用;中和滴定;误差分析等知识。

(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。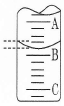
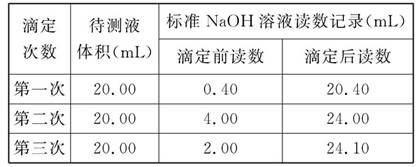
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是( )
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为 (用电离平衡方程式表示)。
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈____(填序号)。
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c= 。
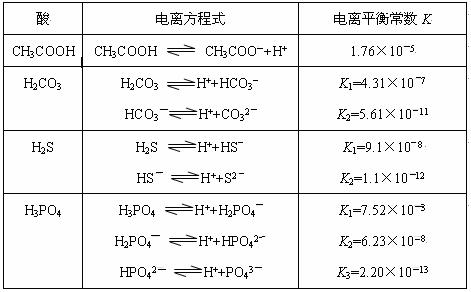
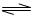 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。