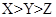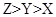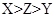题目内容
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3 + 3H2。
完成下列填空:
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________。
(2)C中盛有的试剂为__________。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________。
(4)F中盛有碱石灰,其目的是_________(选填序号)。
a. 吸收HCl b. 吸收Cl2 c. 吸收CO2 d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由 _________________________。
(本题共12分)(1) NaCl + H2SO4(浓) 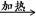 NaHSO4 + HCl↑(1分,写强热亦可,产物为Na2SO4); (2)浓硫酸(1分),B(1分);
NaHSO4 + HCl↑(1分,写强热亦可,产物为Na2SO4); (2)浓硫酸(1分),B(1分);
(3)a(1分);使AlCl3冷凝、收集AlCl3(1分);
(4)ad(2分);
(5)①抑制AlCl3水解(1分);②4(2分);
(6)制得的Cl2中混有HCl,与Al反应生成H2,H2与Cl2混合加热时会发生爆炸(共2分,回答含有HCl得1分,氢氯混合爆炸1分)
解析试题分析:(1)根据氯化铝的制备原理可知,B装置是制备氯化氢的,所以该处反应的化学方程式为NaCl + H2SO4(浓) 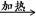 NaHSO4 + HCl↑。
NaHSO4 + HCl↑。
(2)由于氯化铝极易潮解,遇水后会发热并产生白雾,而生成的氯化氢中一定含有水蒸气,所以C装置的作用是干燥氯化氢,因此C中盛放的试剂是浓硫酸。
(3)由于氯化铝178℃时升华,熔点低,其蒸汽易凝结为固体,所以用粗短导管连接D、E的目的是防止凝结生成的氯化铝固体堵塞导管,答案选a;同理可知E瓶的作用是使AlCl3冷凝、收集AlCl3。
(4)反应中氯化氢是过量的,氯化氢是酸性气体,因此碱石灰的作用是吸收氯化氢。又因为AlCl3极易潮解,遇水后会发热并产生白雾,而空气中含有水蒸气,所以碱石灰的另一个作用是吸收空气中的水蒸气,答案选ad。
(5)①氯化铝是强酸弱碱盐,Al3+水解生成氢氧化铝和氯化氢,且水解是吸热的,加热促进水解得不到氯化铝,所以通入氯化氢的目的是抑制AlCl3水解。
②最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则根据铝原子守恒可知2×241.5×40%=267-18.5n,解得n=4。
(6)由于浓盐酸易挥发,所以制得的Cl2中混有HCl,而氯化氢与Al反应生成H2,H2与Cl2混合加热时会发生爆炸,因此该方法比较危险。
考点:考查氯化氢、氯化铝制备;气体的除杂、尾气处理;实验方案设计与评价等

为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;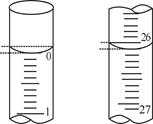
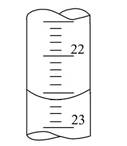
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
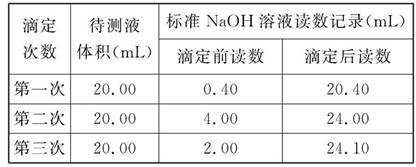
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.1000 mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:
c(HCl)= 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:(填“偏大”、“偏小” 或“无影响”)
A.若取待测液时,开始仰视读数, 后俯视读数,则 ;
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则 。
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
某化学学习小组学习电化学后,设计了下面的实验装置图: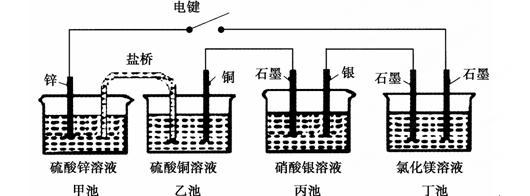
下列有关该装置图的说法中正确的是( )
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
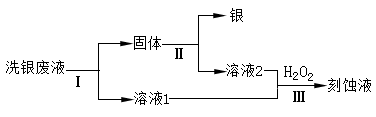
 Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。