题目内容
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
【答案】C
【解析】A.由图象计算Ka1由电离常数可以知道Ka1=![]()
B. 由图象计算Ka1、Ka2,由电离常数可以知道![]() =
=![]() ;
;
C. KHC2O4和K2C2O4的物质的量相同,但如配成不同浓度的溶液,则pH不一定为4.2;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液氢离子浓度减小,对水的电离抑制的程度减小。
A.由图象可以知道pH=1.2时,c(HC2O)=c(H2C2O4),则Ka1=c(H+)=10-1.2,所以A选项是正确的;
B. 由图象可以知道pH=1.2时,c(HC2O)=c(H2C2O4),则Ka1=c(H+)=10-1.2,pH=4.2时,c(HC2O)=c(C2O42-),则Ka2=c(H+)=10-4.2,
由电离常数可以知道![]() =
=![]() =
=![]() =103=1000,所以B选项是正确的;
=103=1000,所以B选项是正确的;
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C错误;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,所以D选项是正确的。
故本题答案选C。

【题目】原电池是化学对人类的一项重大贡献。
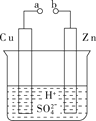
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。