题目内容
【题目】下列有关实验的描述正确的是( )
选项 | 实验内容 | 现象或结论 |
A | 向平衡体系FeCl3+3KSCN | 溶液颜色明显变浅 |
B | 用NaOH溶液滴定盐酸(酚酞作指示剂)至终点 | 溶液由红色变为无色 |
C | 二氧化硫通入到酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,SO2具有还原性 |
D | 将钠置于一定量的乙醇中 | 钠浮在液面上剧烈反应 |
A.AB.BC.CD.D
【答案】C
【解析】
A.FeCl3与KSCN反应的本质是Fe3++3SCN-![]() Fe(SCN)3,平衡移动与KCl固体无关,A项错误;
Fe(SCN)3,平衡移动与KCl固体无关,A项错误;
B.滴定终点现象应该是溶液由无色变为浅红色,B项错误;
C.二氧化硫具有还原性可使酸性高锰酸钾溶液褪色,C项正确;
D.钠的密度比酒精的密度大,并且乙醇中羟基上的氢原子不活泼,故钠应沉入酒精中,并且反应不剧烈,D项错误;
答案选C。

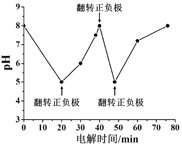
【题目】实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸。在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀。用标准氢氧化钠溶液滴定,直到滴入最后一滴氢氧化钠溶液,指示剂的颜色_______,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数。数据如表:
次数 | 滴定前(mL) | 滴定后(mL) |
1 | 0.40 | 21.10 |
2 | 0.10 |
第2次滴定后滴定管的读数如图所示。根据表中的数据计算出盐酸的浓度为_____mol/L。

【题目】Na2O2具有漂白性和较强的氧化性,下面是某实验小组设计的过氧化钠性质探究实验。回答下列问题:
探究Na2O2与H2反应:
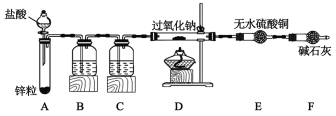
(1)装置B中所盛试剂的名称是___,其作用是___,为了简化实验,可用代替B和C装置___(填写装置名称和装置中所盛试剂的名称)。
(2)装入药品后,点燃D处酒精灯之前的操作是___。
(3)根据下表中的信息,完成对反应情况的探究。
步骤 | 现象 | 结论 |
点燃D处酒精灯 | D中Na2O2逐渐熔化,颜色由①___(填颜色变化),E处无明显现象。 | 加热条件下Na2O2与H2发生反应。 |
反应结束后,待D装置冷却后,取少量D中物质于试管中,加入适量水和几滴酚酞。 | ②___ | Na2O2反应后无剩余,Na2O2与H2反应的化学方程式为:③___。 |
探究Na2O2与水的反应:
(4)用脱脂棉包裹Na2O2粉末,然后滴几滴蒸馏水,发现脱脂棉燃烧起来,试分析其中的原因:___。
(5)有资料显示,Na2O2与水反应后的溶液中有H2O2,设计一个简单的实验证明H2O2的存在:___。