题目内容
【题目】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
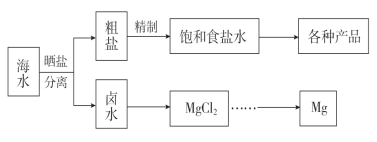
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是______。
②写出产物氯气制备“84”消毒液的离子方程式:______。
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:__________ , __________。
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:
卤水![]()
![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2![]() Mg
Mg
①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式_________;
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式__________。
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:

①上图中,装置a由________、________、双孔塞和导管组成。
②循环物质甲的名称是________。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是______。
【答案】2NaCl(熔融)![]() 2Na+Cl2↑ 2NaOH+Cl2=NaClO+NaCl+H2O NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ 2NaHCO3
2Na+Cl2↑ 2NaOH+Cl2=NaClO+NaCl+H2O NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ 2NaHCO3![]() =Na2CO3+ H2O+CO2↑
=Na2CO3+ H2O+CO2↑ ![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg+Cl2↑ MgCl2+2H2O
Mg+Cl2↑ MgCl2+2H2O![]() Mg(OH)2+H2↑+Cl2↑ 分液漏斗 烧瓶 盐酸 抑制晶体失水过程中的水解
Mg(OH)2+H2↑+Cl2↑ 分液漏斗 烧瓶 盐酸 抑制晶体失水过程中的水解
【解析】
(1)①工业用电解熔融的氯化钠的方法冶炼钠;
②电解氯化钠稀溶液得的氯气可制备“84消毒液”,是氯气与氢氧化钠溶液反应;
③侯氏制碱法是向饱和的氯化钠溶液中通入氨气,再加入二氧化碳,生成碳酸氢钠和氯化铵,碳酸氢钠晶体受热分解生成碳酸钠,二氧化碳和水;
(2) 反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(3) ①采用石墨电极电解熔融的氯化镁,生成镁和氯气;
②电解时,若有少量水存在,变成电解氯化镁溶液,生成氢氧化镁,氢气和氯气;
(4)氯化镁易水解,应在氯化氢气流中获得其晶体,图中a装置提供HCl,在b中经氯化钙干燥后通入c中,c中物质为MgCl26H2O,在氯化氢气流中分解(或风化)生成氯化镁,d为尾气吸收装置,生成的HCl可循环使用。
(1)①工业用电解熔融的氯化钠的方法冶炼钠,反应的方程式为2NaCl(熔融)![]() 2Na+Cl2↑,
2Na+Cl2↑,
故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
②电解氯化钠稀溶液得到的氯气与氢氧化钠溶液可制备“84消毒液”,方程式为2NaOH+Cl2=NaClO+NaCl+H2O,
故答案为:2NaOH+Cl2=NaClO+NaCl+H2O;
③侯氏制碱法是向饱和的氯化钠溶液中通入氨气,再加入二氧化碳,生成碳酸氢钠和氯化铵,碳酸氢钠晶体受热分解生成碳酸钠,二氧化碳和水,反应的化学方程式分别是:
NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ;2NaHCO3![]() =Na2CO3+ H2O+CO2↑,
=Na2CO3+ H2O+CO2↑,
故答案为:NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ;2NaHCO3![]() =Na2CO3+ H2O+CO2↑;
=Na2CO3+ H2O+CO2↑;
(2)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×![]() ×5=
×5=![]() mol,
mol,
故答案为:![]() ;
;
(3)①采用石墨电极电解熔融的氯化镁,生成镁和氯气,其方程式是MgCl2(熔融)![]() Mg+Cl2↑,
Mg+Cl2↑,
故答案为:MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
②电解时,若有少量水存在,变成电解氯化镁溶液,生成氢氧化镁,氢气和氯气,其方程式是:MgCl2+2H2O![]() Mg(OH)2+H2↑+Cl2↑,
Mg(OH)2+H2↑+Cl2↑,
故答案为:MgCl2+2H2O![]() Mg(OH)2+H2↑+Cl2↑;
Mg(OH)2+H2↑+Cl2↑;
(4)①装置用到的仪器有:圆底烧瓶、分液漏斗、双孔塞和导管,
故答案为:分液漏斗;烧瓶;
②氯化镁易水解,应在氯化氢气流中获得其晶体,氯化氢可以循环使用,
故答案为:盐酸;
③如果直接在空气中加热MgCl26H2O,则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,
故答案为:抑制晶体失水过程中的水解。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】Na2O2具有漂白性和较强的氧化性,下面是某实验小组设计的过氧化钠性质探究实验。回答下列问题:
探究Na2O2与H2反应:

(1)装置B中所盛试剂的名称是___,其作用是___,为了简化实验,可用代替B和C装置___(填写装置名称和装置中所盛试剂的名称)。
(2)装入药品后,点燃D处酒精灯之前的操作是___。
(3)根据下表中的信息,完成对反应情况的探究。
步骤 | 现象 | 结论 |
点燃D处酒精灯 | D中Na2O2逐渐熔化,颜色由①___(填颜色变化),E处无明显现象。 | 加热条件下Na2O2与H2发生反应。 |
反应结束后,待D装置冷却后,取少量D中物质于试管中,加入适量水和几滴酚酞。 | ②___ | Na2O2反应后无剩余,Na2O2与H2反应的化学方程式为:③___。 |
探究Na2O2与水的反应:
(4)用脱脂棉包裹Na2O2粉末,然后滴几滴蒸馏水,发现脱脂棉燃烧起来,试分析其中的原因:___。
(5)有资料显示,Na2O2与水反应后的溶液中有H2O2,设计一个简单的实验证明H2O2的存在:___。
【题目】正丁醚是一种用途很广的化工产品,毒性和危险性小,是安全性很高的有机溶剂,对许多天然及合成油脂、树脂、橡胶、有机酸酯、生物碱等都有很强的溶解能力,还可作为电子级清洗剂和多种有机合成材料。可通过以下反应原理制取正丁醚:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
己知相关物质的部分信息如下:
沸点(℃) | 密度(g/cm3) | 溶解度(g) | 相对分子质量 | |
正丁醇 | 117.7 | 0.81 | 7.9 | 74 |
正丁醚 | 142 | 0.77 | 不溶于水 | 130 |
某课外化学学习小组查阅相关资料设计了以下实验步骤合成正丁醚:
①在100 mL两口烧瓶中加入30.0 mL正丁醇、5.0 mL浓硫酸和几粒沸石,充分摇匀。在分水器中加入3.0 mL饱和食盐水,按图甲组装仪器,接通冷凝水;
②反应:在电热套上加热,使瓶内液体微沸,回流反应约1小时。当馏液充满分水器时,打开分水器放出一部分水。当水层不再变化,瓶中反应温度达150 ℃,反应己基本完成,停止加热;
③蒸馏:待反应液冷却后,拆下分水器,将仪器改成蒸馏装置如图丙,再加几粒沸石,蒸馏,收集馏分;
④精制:将馏出液倒入盛有10 mL水的分液漏斗中,充分振摇,静置弃去水液,有机层依次用5 mL水,3 mL 5% NaOH溶液、3 mL水和3 mL饱和氯化钙溶液洗涤,分去水层,将产物放入洁净干燥的小锥形瓶中,然后加入0.2~0.4 9无水氯化钙,再将液体转入装置丙中进行蒸馏,收集到馏分9.0 mL。
甲. 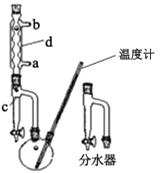 乙.
乙. ![]() 丙.
丙.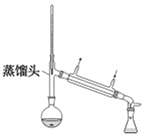
请根据以上操作回答下列问题:
(1)制备正丁醚的反应类型是___,仪器d的名称是____。
(2)在步骤①中添加试剂的顺序是____。相比装置乙,装置甲的优点是 ___。
(3)在步骤②中采用电热套加热而不采用酒精灯直接加热的原因可能是____。
(4)在步骤③中收集馏分适宜的温度范围为____(填正确答案标号)。
A.115℃~ll9℃ B.140℃~144℃ C. 148℃~152℃
(5)在精制中,有机层在____层(填“上”或“下”),加入无水氯化钙的作用是____。
(6)本小组实验后所得正丁醚的产率约为 ___%(计算结果保留一位小数)。