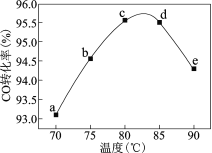
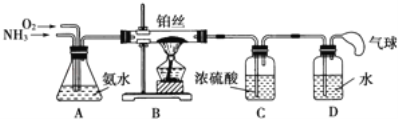
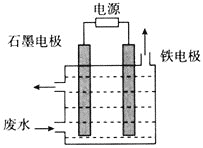
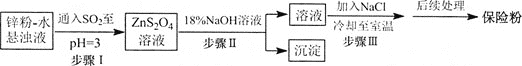
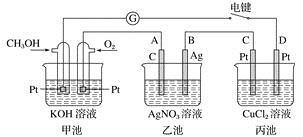
题目内容
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,降低温度产生的影响为( )
2SO3(g) ΔH<0,降低温度产生的影响为( )
A.v正 增大,v逆减小B.v正减小,v逆增大
C.v正和v逆同程度的增大D.v正和v逆不同等程度的减小
【答案】D
【解析】
A、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,选项A错误;
B、降低温度,正逆化学反应速率都减小,即v正减小,v逆减小,选项B错误;
C、降低温度,化学平衡向着放热方向进行,即向着正方向进行,正反应速率大于逆反应速率,即逆反应速率降低的程度大,选项C错误;
D、降低温度,化学平衡向着放热方向进行,即向着正方向进行,但是减少程度不一样,正逆反应速率不相等,正反应速率大于逆反应速率,正反应速率减小的少,选项D正确;
答案选D。

【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。