题目内容
【题目】在定温定容的密闭容器中合成 ![]() 。下列不能说明反应
。下列不能说明反应 ![]() 达到化学平衡状态的是
达到化学平衡状态的是
A.![]() B.容器内的压强不再改变
B.容器内的压强不再改变
C.![]() 的生成速率与
的生成速率与 ![]() 的消耗速率相等D.
的消耗速率相等D.![]() 的转化率不再改变
的转化率不再改变
【答案】A
【解析】
从化学平衡的本质和特征两方面,分析判断化学平衡的标志。
A.化学平衡时,体系中各物质的物质的量或浓度不再随时间发生变化,但不一定相等,也不一定为化学计量数之比,故A选;
B.据PV=nRT,定温定容的密闭容器中,容器内的压强不再改变时,气体总物质的量不再变化,故反应已达化学平衡,故B不选;
C.当SO3的生成速率与SO3的消耗速率相等时,容器中各物质的物质的量不再变化,达到化学平衡状态,故C不选;
D.当SO2的转化率不再改变时,容器中SO2等物质的物质的量都保持不变,达到化学平衡状态,故D不选;
故选A。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是 ______。
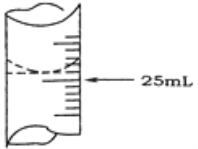
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为______________ 。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为_____________ (小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高(_________) (填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是____。