题目内容
【题目】连二亚硫酸钠![]() 俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。
俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。![]() 易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
![]() 在潮湿空气中氧化,生成的两种常见酸式盐是________
在潮湿空气中氧化,生成的两种常见酸式盐是________![]() 填化学式
填化学式![]() 。
。
![]() 锌粉法制备
锌粉法制备![]() 的工艺流程如下图所示:
的工艺流程如下图所示:
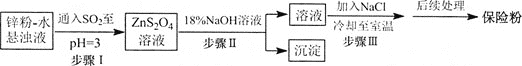
![]() 工业上常将锌块进行预处理得到锌粉
工业上常将锌块进行预处理得到锌粉![]() 水悬浊液,其目的是________。
水悬浊液,其目的是________。
![]() 步骤Ⅰ中发生反应的化学方程式为________。
步骤Ⅰ中发生反应的化学方程式为________。
![]() 在步骤Ⅲ中得到的
在步骤Ⅲ中得到的![]() 固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的
固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的![]() 固体,其原因是________。
固体,其原因是________。
![]() 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入
目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入![]() 发生反应,有
发生反应,有![]() 气体放出,总反应的离子方程式是________。
气体放出,总反应的离子方程式是________。
![]() 有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠
有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠![]() ,并获得中国专利。电解过程中,阴极室生成
,并获得中国专利。电解过程中,阴极室生成![]() ,a极的电极反应式为________,通过阳离子交换膜的离子主要是
,a极的电极反应式为________,通过阳离子交换膜的离子主要是![]() ,其迁移方向是________。
,其迁移方向是________。

【答案】![]() 和
和![]() 增大锌粒的表面积,加快化学反应速率
增大锌粒的表面积,加快化学反应速率 ![]() 减少
减少![]() 的溶解损失,易于干燥
的溶解损失,易于干燥 ![]() 为碱性物质,“保险粉”在碱性介质中较稳定
为碱性物质,“保险粉”在碱性介质中较稳定 ![]()
![]() 从阳极室到阴极室
从阳极室到阴极室![]() 或a到
或a到![]()
【解析】
(1) Na2S2O4在潮湿空气中被氧化,S元素的化合价升高为+4、+6;
(2)由制备流程可知,锌粉加水形成分散系,再通入二氧化硫反应得到ZnS2O4,加入NaOH溶液反应得到氢氧化锌沉淀、Na2S2O4,最后加入NaCl降低Na2S2O4的溶解度,析出Na2S2O4 ;
(3)由信息可知将甲酸钠和烧碱加入乙醇水溶液溶解后,通入SO2发生反应,有CO2气体放出,发生 HCOONa + NaOH + 2SO2 = Na2S2O4+CO2+H2O;
(4)电解过程中, 阴极室生成 Na2S2O4,a与电源正极相连为阳极,硫酸根离子失去电子生成S2O82-,阳离子向阴极移动,以此来解答。
![]() 在潮湿空气中氧化,生成的两种常见酸式盐是
在潮湿空气中氧化,生成的两种常见酸式盐是![]() 和NaHSO4;
和NaHSO4;![]() :
:![]() 和
和![]() ;
;
![]() 工业上将锌块进行预处理得到锌粉
工业上将锌块进行预处理得到锌粉![]() 水悬浊液,其目的是增大锌粒的表面积,加快化学反应速率;故答案为:增大锌粒的表面积,加快化学反应速率;
水悬浊液,其目的是增大锌粒的表面积,加快化学反应速率;故答案为:增大锌粒的表面积,加快化学反应速率;
![]() 步骤Ⅰ中锌粉
步骤Ⅰ中锌粉![]() 水悬浊液中通入
水悬浊液中通入![]() 至
至![]() 则生成了
则生成了![]() ,则反应的化学方程式为;故答案为:
,则反应的化学方程式为;故答案为:![]() ;
;
![]() 易溶于水,难溶于乙醇,所以在步骤Ⅲ中得到的
易溶于水,难溶于乙醇,所以在步骤Ⅲ中得到的![]() 固体要用乙醇洗涤,其优点是减少
固体要用乙醇洗涤,其优点是减少![]() 的溶解损失,易于干燥;
的溶解损失,易于干燥;
![]() 在碱性介质中较稳定,在空气中易被氧化,
在碱性介质中较稳定,在空气中易被氧化,![]() 为碱性物质,所以“后续处理”最终要加入少量的
为碱性物质,所以“后续处理”最终要加入少量的![]() 固体,其原因是
固体,其原因是![]() 为碱性物质,“保险粉”在碱性介质中较稳定;故答案为:减少
为碱性物质,“保险粉”在碱性介质中较稳定;故答案为:减少![]() 的溶解损失,易于干燥;
的溶解损失,易于干燥;![]() 为碱性物质,“保险粉”在碱性介质中较稳定;
为碱性物质,“保险粉”在碱性介质中较稳定;
![]() 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入
目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入![]() 发生反应,有
发生反应,有![]() 气体放出,所以总反应的离子方程式是
气体放出,所以总反应的离子方程式是![]() ,
,
故答案为:![]() ;
;
![]() 电极与电源的正极相连,为阳极,则发生氧化反应,则生成
电极与电源的正极相连,为阳极,则发生氧化反应,则生成![]() ,电极反应式为
,电极反应式为![]() ,电解过程中,阳离子向阴极移动,所以
,电解过程中,阳离子向阴极移动,所以![]() 迁移方向是从阳极室到阴极室
迁移方向是从阳极室到阴极室![]() 或a到
或a到![]() ,故答案为:
,故答案为:![]() 从阳极室到阴极室
从阳极室到阴极室![]() 或a到
或a到![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】有四种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填写:
(1)B原子的简化电子排布式_____。
(2)A元素在周期表中的位置_____;离子半径:A_____B(填>、=或< )。
(3)E原子的价电子排布图是____,其原子核外有______个未成对电子,能量最高的电子为_____轨道上的电子,其轨道呈_____形。
(4)D原子的外围电子排布式为____,D-的离子结构示意图是_____。
(5)C、E元素的第一电离能的大小关系是_____(用元素符号表示,下同)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是____,CD3的中心原子杂化轨道类型是___,CD3与水反应的化学方程式是_____。
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反应温度T℃__400℃(填“>”或“<”或“=”);
②乙容器中,0~40min内平均反应速率v(N2)=__;
③丙容器中达平衡后NO的转化率为__。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中NO2的转化率最高的是__点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=__MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为__。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,则用氨水将SO2转化为NH4HSO3的离子方程式为__;实验测得NH4HSO3溶液中![]() =15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)