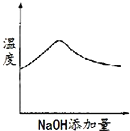
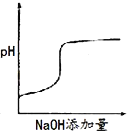
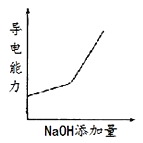
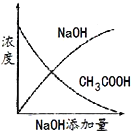
МвДҝДЪИЭ
ЎҫМвДҝЎҝ№ӨТөЙПҝЙНЁ№эјЧҙјфК»щ»Ҝ·ЁЦЖИЎјЧЛбјЧхҘЈЁHCOOCH3Ј©ЈәCH3OHЈЁgЈ©+ COЈЁgЈ©=HCOOCH3ЈЁgЈ©Ј¬ФЪИЭ»э№М¶ЁөДГЬұХИЭЖчЦРЈ¬Н¶ИлөИОпЦКөДБҝCH3OHәНCOЈ¬ІвөГПаН¬КұјдДЪCOөДЧӘ»ҜВКЛжОВ¶Иұд»ҜИзУТНјЛщКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
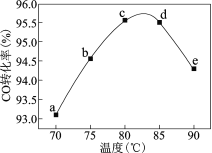
A.ФцҙуС№ЗҝјЧҙјЧӘ»ҜВКФцҙу
B.bөг·ҙУҰЛЩВКҰФХэ = ҰФДж
C.ЖҪәвіЈКэK(75Ўж)ЈҫK(85Ўж)Ј¬·ҙУҰЛЩВКҰФbЈјҰФd
D.ЙъІъКұ·ҙУҰОВ¶ИҝШЦЖФЪ80~85ЎжОӘТЛ
Ўҫҙр°ёЎҝB
ЎҫҪвОцЎҝ
AЎўОВ¶Иі¬№эФј83ЎжКұЈ¬ЛжЧЕОВ¶ИөДЙэёЯЈ¬COөДЧӘ»ҜВКҪөөНЈ¬ЛөГчёГ·ҙУҰКЗҝЙДж·ҙУҰЈ»УЙУЪёГ·ҙУҰКЗЖшМеМе»эјхРЎөД·ҙУҰЈ¬ФцҙуС№ЗҝҝЙТФК№ЖҪәвХэПтТЖ¶ҜЈ¬јҙФцҙујЧҙјөДЧӘ»ҜВКЈ¬AХэИ·Ј»
BЎўМвЦРЛөГчёГЗъПЯКЗІвөГПаН¬КұјдДЪCOөДЧӘ»ҜВКЛжОВ¶Иұд»ҜЗъПЯЈ¬Іў·ЗКЗФЪІ»Н¬ОВ¶ИПВөДЖҪәвЧӘ»ҜВКЈ»bөгЦ®әуЈ¬ИФУРТ»¶ОЗъПЯұнКҫCOөДЧӘ»ҜВКЛжОВ¶ИЙэёЯ¶шЙэёЯЈ¬ЛөГчbөгІ»КЗЖҪәвЧҙМ¬Ј¬ФтҙЛКұХэ·ҙУҰЛЩВКІ»өИУЪДж·ҙУҰЛЩВКЈ¬BҙнОуЈ»
CЎўОВ¶Иі¬№эФј83ЎжКұЈ¬ЛжЧЕОВ¶ИөДЙэёЯЈ¬COөДЧӘ»ҜВКҪөөНЈ¬ФтЛөГчёГ·ҙУҰКЗ·ЕИИ·ҙУҰЈ»¶ФУЪ·ЕИИ·ҙУҰ¶шСФЈ¬ОВ¶ИФҪёЯЈ¬ЖҪәвіЈКэKФҪРЎЈ¬№КK(75Ўж)ЈҫK(85Ўж)Ј»bөгөДОВ¶ИұИdөгөДөНЈ¬№КҰФbЈјҰФdЈ¬CХэИ·Ј»
DЎўёщҫЭНјҝЙЦӘЈ¬ОВ¶ИФЪ80~85ЎжөД·¶О§ДЪЈ¬COөДЧӘ»ҜВКЧоёЯЈ¬і¬№эёГОВ¶И·¶О§Ј¬ЛжЧЕОВ¶ИөДЙэёЯЈ¬COөДЧӘ»ҜВКҪөөНЈ¬ЛөГч·ҙУҰөДЧоККОВ¶ИФЪ80~85ЎжЦ®јдЈ¬№КЙъІъКұ·ҙУҰОВ¶ИҝШЦЖФЪ80~85ЎжОӘТЛЈ¬DХэИ·Ј»
№КСЎBЎЈ

 УдҝмөДә®јЩДПҫ©іц°жЙзПөБРҙр°ё
УдҝмөДә®јЩДПҫ©іц°жЙзПөБРҙр°ёЎҫМвДҝЎҝПыіэөӘСх»ҜОпЎў¶юСх»ҜБтөИОпЦКФміЙөДОЫИҫКЗДҝЗ°СРҫҝөДЦШТӘҝОМвЎЈ
(1)№ӨТөЙПіЈУГ»оРФМҝ»№ФӯТ»Сх»ҜөӘЈ¬Жд·ҙУҰОӘЈә2NO(g)+C(s)![]() N2(g)+CO2(g)ЎЈПтИЭ»эҫщОӘlLөДјЧЎўТТЎўұыИэёцәгИЭәгОВИЭЖчЦР·ЦұрјУИлЧгБҝөД»оРФМҝәНТ»¶ЁБҝөДNOЈ¬ІвөГёчИЭЖчЦРn(NO)Лж·ҙУҰКұјдtөДұд»ҜЗйҝцИзПВұнЛщКҫЈә
N2(g)+CO2(g)ЎЈПтИЭ»эҫщОӘlLөДјЧЎўТТЎўұыИэёцәгИЭәгОВИЭЖчЦР·ЦұрјУИлЧгБҝөД»оРФМҝәНТ»¶ЁБҝөДNOЈ¬ІвөГёчИЭЖчЦРn(NO)Лж·ҙУҰКұјдtөДұд»ҜЗйҝцИзПВұнЛщКҫЈә
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
јЧ | TЎж | 2 | 1.45 | 1 | 1 | 1 |
ТТ | 400Ўж | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
ұы | 400Ўж | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
ўЩјЧИЭЖч·ҙУҰОВ¶ИTЎж__400Ўж(МоЎ°>Ўұ»тЎ°<Ўұ»тЎ°=Ўұ)Ј»
ўЪТТИЭЖчЦРЈ¬0Ў«40minДЪЖҪҫщ·ҙУҰЛЩВКv(N2)=__Ј»
ўЫұыИЭЖчЦРҙпЖҪәвәуNOөДЧӘ»ҜВКОӘ__ЎЈ
(2)»оРФМҝ»№ФӯNO2өД·ҙУҰОӘЈә2NO2(g)+2C(s)![]() N2(g)+2CO2(g)Ј¬ФЪәгОВМхјюПВЈ¬lmolNO2әНЧгБҝ»оРФМҝ·ўЙъёГ·ҙУҰЈ¬ІвөГЖҪәвКұNO2әНCO2өДОпЦКөДБҝЕЁ¶ИУлЖҪәвЧЬС№өД№ШПөИзНјЛщКҫЈә
N2(g)+2CO2(g)Ј¬ФЪәгОВМхјюПВЈ¬lmolNO2әНЧгБҝ»оРФМҝ·ўЙъёГ·ҙУҰЈ¬ІвөГЖҪәвКұNO2әНCO2өДОпЦКөДБҝЕЁ¶ИУлЖҪәвЧЬС№өД№ШПөИзНјЛщКҫЈә

ўЩAЎўBЎўCИэөгЦРNO2өДЧӘ»ҜВКЧоёЯөДКЗ__өг(МоЎ°AЎұ»тЎ°BЎұ»тЎ°CЎұ)ЎЈ
ўЪјЖЛгCөгКұёГ·ҙУҰөДС№ЗҝЖҪәвіЈКэKP=__MPa(KpКЗУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЈ¬·ЦС№=ЧЬС№ЎБОпЦКөДБҝ·ЦКэ)ЎЈ
(3)ИјГәСМЖшНСБтіЈУГИзПВ·Ҫ·ЁЎЈ
·Ҫ·ЁўЩЈәУГЙъОпЦКИИҪвЖш(ЦчТӘіЙ·ЦCOЎўCH4ЎўH2)Ҫ«SO2ФЪёЯОВПВ»№ФӯіЙөҘЦКБтЎЈЙжј°өДІҝ·Ц·ҙУҰИзПВЈә
2CO(g)+SO2(g)=S(g)+2CO2(g) ЎчH1=8.0kJЎӨmol-1
2CO(g)+O2(g)=2CO2(g) ЎчH2=Јӯ566.0kJЎӨmol-1
2H2(g)+O2(g)=2H2O(g) ЎчH3=Јӯ483.6kJЎӨmol-1
ФтH2(g)»№ФӯSO2(g)ЙъіЙS(g)әНH2O(g)өДИИ»ҜС§·ҪіМКҪОӘ__ЎЈ
·Ҫ·ЁўЪЈәУГ°ұЛ®Ҫ«SO2ЧӘ»ҜОӘNH4HSO3Ј¬ФЩСх»ҜіЙ(NH4)2SO4Ј¬ФтУГ°ұЛ®Ҫ«SO2ЧӘ»ҜОӘNH4HSO3өДАлЧУ·ҪіМКҪОӘ__Ј»КөСйІвөГNH4HSO3ИЬТәЦР![]() =15Ј¬ФтИЬТәөДpHОӘ__ЎЈ(ТСЦӘЈәH2SO3өДKa1=1.5ЎБ10-2Ј¬Ka2=1.0ЎБ10-7)
=15Ј¬ФтИЬТәөДpHОӘ__ЎЈ(ТСЦӘЈәH2SO3өДKa1=1.5ЎБ10-2Ј¬Ka2=1.0ЎБ10-7)