题目内容
2.下列各组物质中,互为同位素的是( )| A. | 甲烷和乙烷 | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
分析 质子数相同中子数不同的同一元素的不同原子互称同位素,据此分析解答.
解答 解:A、甲烷和乙烷是化合物不是原子,所以不是同位素,故A错误;
B、正丁烷和异丁烷是化合物不是原子,所以不是同位素,故B错误;
C、金刚石和石墨是碳元素形成的不同的单质,不是同位素,故C错误;
D、35Cl和37Cl是质子数相同中子数不同的同一元素,互称同位素,故D正确,故选D.
点评 本题考查了同位素的概念,明确同位素、同素异形体等概念是解本题的关键,难度不大,注意这几个概念的区别.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
12.反应N2+3H2?2NH3,开始时N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,3min后测得NH3浓度为0.6mol•L-1,则此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
13.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
17.在5L的密闭容器中进行下述反应:4NH3+5O2=═4NO+6H20,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
7.如表是元素周期表的一部分,按要求完成各小题.
(1)元素①的元素符号:Na
(2)元素⑧的单质电子式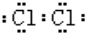
(3)元素⑤的原子结构示意图
(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式
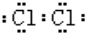
(3)元素⑤的原子结构示意图

(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
14.某烷烃的式量为72,跟Cl2反应生成的一卤代物只有一种,该烷烃是( )
| A. | 戊烷 | B. | 乙烷 | C. | 2-甲基丁烷 | D. | 2,2-二甲基丙烷 |
 ,由两种元素组成的三原子共价化合物的电子式
,由两种元素组成的三原子共价化合物的电子式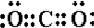 或
或 .(各写1种)
.(各写1种)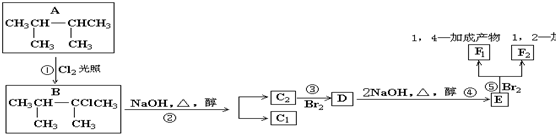
 ;
;