题目内容
12.中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+的浓度来测定溶液的pH.已知100℃时,水的离子积常数KW=1×10-12.(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是BD(填字母).
A.向水中加入NaHSO4 B.向水中加入Cu(NO3)2 C.加热水至100℃D.在水中加入(NH4)2SO4
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,呈中(填“酸”、“碱”或“中”)性;若用pH计测定,则pH<(填“>”、“=”或“<”)7,溶液呈中(填“酸”、“碱”或“中”)性.
(3)常温下,现用预先用水润湿的pH试纸测得某氨基酸溶液的pH等于8,则原溶液的pH>8(填“>”、“=”或“<”)
分析 (1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性;
(3)用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,据此进行分析判断.
解答 解:(1)A.向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中C(H+)>C(OH-),溶液呈酸性,故A错误;
B.向水中加入Cu(NO3)2,Cu(NO3)2是强酸弱碱盐能水解,铜离子和氢氧根离子结合生成氢氧化铜,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故B正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4,(NH4)2SO4是强酸弱碱盐能水解,铵根离子与氢氧根离子结合生成一水合氨,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故D正确;
故选BD;
(2)温度升高会促进水的电离,所以水的pH会减小,所以100℃沸水仍然是中性的,但此时的pH值小于7,pH试纸测定溶液的酸碱性时,试纸为淡黄色,水在任何温度下均为中性的,
故答案为:淡黄;中;<;中;
(3)常温下,溶液pH的测得值为8,说明溶液为碱性溶液,由于碱性溶液稀释后,溶液碱性减弱,测定的pH偏小,所以该氨基酸溶液的实际pH应大于8,
故答案为:>.
点评 本题考查了水的电离平衡和溶液酸碱性的关系,题目难度不大,注意从题干中提取pH试纸的使用的有效信息.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 甲烷和乙烷 | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
| A. | 该过程中热能转化为化学能 | |
| B. | 反应物的总能量小于生成物的总能量 | |
| C. | 该过程中化学能转化为电能 | |
| D. | 反应物的总能量大于生成物的总能量 |
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(2)反应Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O中的氧化剂为Cl2.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-也不存在ClO-
②基于假设3(即验证假设3成立),设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1H2SO4、1mom.L-1NaOH、0.01mol.L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | |
| 步骤2:向A试管中滴加1-2滴0.01mol.L-1KMnO4溶液. | 溶液呈浅紫色,则证明不存在SO32-, 则证明不存在SO32-. |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液. | 溶液不变蓝色, 则证明不存在ClO-. |
| A. | N2与H2在一定条件下反应生成NH3 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | 雷雨时空气中的N2转化为NO | D. | 由NH3制碳酸氢铵和硫酸铵 |
| A. | 氧化铜与硫酸反应 | B. | 氢氧化铝与硫酸反应 | ||
| C. | 木炭粉与浓硫酸反应 | D. | 铜与浓硫酸反应 |
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷的燃烧热为-2878kJ•mol-1 | |
| B. | 正丁烷分子所具有的能量大于异丁烷分子 | |
| C. | 等量的异丁烷分子中碳氢键比正丁烷的多 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
| A. | 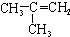 | B. | CH2=CH-CH=CH2 | C. |  | D. | 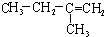 |