题目内容
7.如表是元素周期表的一部分,按要求完成各小题.| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)元素⑧的单质电子式

(3)元素⑤的原子结构示意图

(4)①③⑤⑧⑩中,化学性质最不活泼的元素Ar(填元素,下同),非金属性最强的元素是Cl,金属性最强的单质Na.
(5)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①②③三种元素的原子半径最大的是K.
(6)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物和盐酸反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,单质与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 根据元素在周期表中的位置知,①~⑩10种元素分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
(1)根据元素在周期表中的位置知①的元素符号是Na;
(2)氯气分子中,2个氯原子通过共用一对电子,形成共价键;
(3)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,据此书写其原子结构示意图;
(4)这些元素中,Ar元素化学性质最不活泼,在这些元素中,金属性最强的元素在周期表左下角、非金属性最强的元素在周期表右上角,据此回答;
(5)元素的金属性越强,其最高价氧化物是水化物碱性越强,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素中,原子半径随着原子序数增大而增大,据此回答;
(6)元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物是Al(OH)3呈两性,据此书写有关反应的化学方程式.
解答 解:根据元素在周期表中的位置知,①~⑩10种元素分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar元素,
(1)根据元素在周期表中的位置知①的元素符号是Na,故答案为:Na;
(2)氯气分子中,2个氯原子通过共用一对电子,形成共价键,电子式为: ,故答案为:
,故答案为: ;
;
(3)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)这些元素中,Ar元素化学性质最不活泼,在这些元素中,非金属性最强的元素在周期表右上角,①③⑤⑧⑩中非金属性最强的元素是Cl,金属性最强的元素在周期表左下角,①③⑤⑧⑩中金属性最强的元素是Na,故答案为:Ar;Cl;Na;
(5)元素的金属性越强,其最高价氧化物是水化物碱性越强,①③⑤三种元素的最高价氧化物水化物中,碱性最强的是NaOH,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素中,原子半径随着原子序数增大而增大,①②③三种元素的原子半径最大的是K,故答案为:NaOH;K;
(6)元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素的最高价氧化物的水化物是Al(OH)3呈两性,它和盐酸反应的学方程式为:Al(OH)3+3HCl=AlCl3+3H2O,铝单质与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al(OH)3+3HCl=AlCl3+3H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了元素周期表和元素周期律综合应用,根据原子结构、分子结构及物质性质、元素周期律等知识来分析解答,注意电子式和化学方程式的书写.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: -COOH、-OH. |
(4)A的核磁共振氢谱如下图: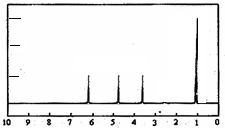 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式  . . | |
| A. | 甲烷和乙烷 | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
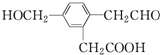 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
| A. | ②③④ | B. | ①③④⑤⑥ | C. | ①③④⑤ | D. | ①③⑤⑥ |
| A. | 直接分液 | |
| B. | 加入氢氧化钠溶液后,充分振荡,静置后分液 | |
| C. | 直接蒸馏 | |
| D. | 加入过量溴水,过滤 |
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | Na2SO4溶液:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{kW}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
| A. | N2与H2在一定条件下反应生成NH3 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | 雷雨时空气中的N2转化为NO | D. | 由NH3制碳酸氢铵和硫酸铵 |
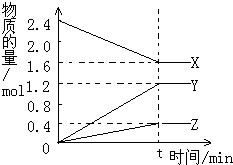 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: