题目内容
17.在5L的密闭容器中进行下述反应:4NH3+5O2=═4NO+6H20,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),再根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.
解答 解:在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•min).
A、速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.002mol/(L•min)=0.0025mol/(L•min),故A错误;
B、v(NO)=0.002mol/(L•min),故B错误;
C、速率之比等于化学计量数之比,所以v(H2O)=$\frac{3}{2}$v(NO)=$\frac{3}{2}$×0.002mol/(L•min)=0.003mol/(L•min),故C错误;
D、速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•min),故D正确.
故选D.
点评 本题考查化学反应速率的计算,比较基础,反应速率计算通常有定义法、化学计量数法,根据情况选择合适的方法.

练习册系列答案
相关题目
5.已知R原子有b个中子,R2+核外有a个电子.表示R原子符号正确的是( )
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
12.某有机物中有一个C6H5-,一个-CH2-,一个-C6H4-,一个-OH,则该有机物中能使FeCl3溶液显紫色结构有( )
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
2.下列各组物质中,互为同位素的是( )
| A. | 甲烷和乙烷 | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
9.下列关于甲烷性质叙述中不正确的是( )
| A. | 甲烷一种无色无味的气体 | B. | 甲烷性质稳定,不和其它物质反应 | ||
| C. | 甲烷极难溶解于水 | D. | 甲烷密度比空气的密度小 |
6.某有机物的结构简式为CH2=CHCH2-CH2OH,下列对其化学性质的判断中,不正确的( )
| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
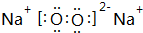 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.